分子式顕微鏡プライマー:蛍光-光退色-インタラクティブチュートリアル
- 蛍光顕微鏡インタラクティブチュートリアル
- 光退色
- 質問やコメントは? 私達に電子メールを送って下さい。
- デイビッドソンとフロリダ州立大学。 すべての権利を保有します。 いかなる画像、グラフィック、スクリプト、アプレットも、著作権者の許可なく複製または使用することはできません。 このウェブサイトの使用は、あなたが所有者によって定められた法的条件のすべてに同意することを意味します。
- このウェブサイトは、私たちのグラフィックス&ウェブプログラミングチーム国立高磁場研究所の光学顕微鏡と共同で。
- 最終更新日:2016年9月12日月曜日01:58PM
- 2003年6月10日以降のアクセス数: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
蛍光顕微鏡インタラクティブチュートリアル
光退色
光退色の現象(また、一般的にフェージングと呼ばれる)は、フルオロフォアが永久に光子のために蛍光を発する能力を失ったときに起こる。-誘発された化学的損傷および共有結合修飾。 励起一重項状態から励起三重項状態への遷移時に、フルオロフォアは、不可逆的な共有結合修飾を生成するために、別の分子と相互作用し得る。 三重項状態は一重項状態に対して比較的長寿命であり、励起された分子が環境中の成分と化学反応を受けるのにはるかに長い時間枠を可能にする。 光退色前に特定のフルオロフォアで発生する励起および発光サイクルの平均数は、分子構造および局所環境に依存する。 いくつかの蛍光色素は、わずか数光子を放出した後すぐに漂白するが、より堅牢なものは、漂白前に数千または数百万サイクルを受ける可能性がある。 このインタラクティブなチュートリアルでは、単一、二重、および乗算標識蛍光試料における光漂白速度の変化を探ります。
チュートリアルでは、Unbleached ImageウィンドウとPhotobleached Imageウィンドウに表示される同一の蛍光画像のペアで初期化されます。 チュートリアルを操作するには、シャッターボタンをクリックして仮想シャッターを開き、一定期間にわたって大幅に誇張された速度で光漂白画像をフェードまたは光漂白できるようにします。 フェージングは、一時停止ボタン(開始ボタンになる)をクリックすることで任意の時点で停止し、開始ボタンをクリックして再開することができます。 二重および三重の分類された標本では、さまざまな個々のfluorophoreの漂白率は色チャネルのチェック-ボックスを使用してそれぞれ見ることができます(デフォル 例えば、三重の分類が付いている標本のための赤いチェック-ボックスをかちりと鳴らすことは赤い色チャネルだけ示します。 [追加]チェックボックスを使用して、2つまたは3つすべてのカラーチャンネルを乗算ラベル付き標本に混在させることができます。 新しい標本は標本の選択プルダウンメニューを使用して選ぶことができます。 Fitc、fluorescein isothiocyanate;triple、a red、green、およびblue fluorophore;Dual、2つのfluorophores;DAPI、4’、6−diamidino−2−phenylindole;Mitotracker、mitchondrial probe;Alexa4 8 8、green fluorophore;dapi、4’、6−diamidino−2−phenylindole; そして自動、autofluorescence。 このチュートリアルでは、リロード時に個々の蛍光色素の光漂白率をランダムに変更するように設計されているため、シャッターボタンを繰り返しクリックすると、各色信号の蛍光漂白率が変化するときに画像がどのように表示されるかが示されます。
光退色、非常によく理解されていない現象は、ほとんどの試料で蛍光発光強度の劇的な損失につながるので、アーティファクトを制御することは、満足のいく画像をキャプチャするために重要です。 典型的な蛍光色素の例として、中から高照度でのフルオレセインの光退色の量子収率は、平均分子がその有用な寿命の間に(永久に無効になる前に)30-40万光子の間で放出することを指示する。 さらに、励起および放出サイクルの数は、励起エネルギーが離散パルスまたは連続照明のいずれかでどのように供給されるかにかかわらず、所与のフ したがって、中性密度フィルタを使用して励起光レベルを低下させることは、光退色を防止するものではなく、単に速度を低下させるだけである。
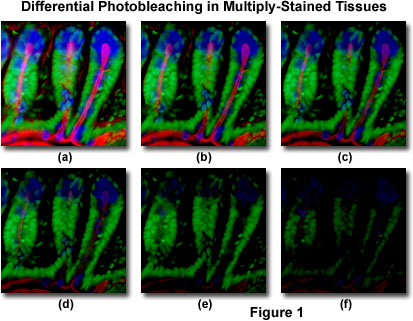
図1に示すのは、マウス腸の16マイクロメートルのクライオスタットの薄い部分について、異なる時点で撮影された一連のデジタル画像で観察された光退色(フェージング)の典型的な例である。 核はSytox Green(緑色蛍光)で染色し、杯細胞の粘液およびブラシ境界の糸状アクチンは、それぞれAlexa Fluor3 5 0小麦胚芽凝集素(青色蛍光)およびAlexa Fluor5 6 8phalloidin(赤色蛍光)で染色した。 三つの蛍光体を同時に励起するように調整された帯域幅を有する蛍光フィルタの組み合わせを用いて,時間点を二分間隔で撮影した。 図1(a)では、3つの蛍光体すべてが比較的高い強度を持っていますが、Alexa Fluor350と568(青と赤)の強度は2分で急速に低下し始め、6分でほぼ完全に消えてい 緑色で染色された核は光退色に対してより耐性があるが、それらの強度はまた、時限配列(10分)の過程で着実に低下する。 いろいろ総合的なantifadeの試薬はかなりphotobleachingの率を減らします。
光漂白イベントの重要なクラスは、光力学的であり、それらは光と酸素の組み合わせとフルオロフォア 蛍光体と分子酸素との間の反応は、蛍光を永久に破壊し、生きている細胞内の他の分子を化学的に修飾することができるフリーラジカル一重項酸素種 光力学的事象による光退色の量は、分子酸素濃度およびフルオロフォア、酸素分子、および他の細胞成分との間の近位距離の関数である。 光退色は、蛍光体の露光時間を照明に制限することによって、または励起エネルギーを低下させることによって低減することができる。 しかしながら、これらの技術はまた、測定可能な蛍光信号を減少させる。 多くの場合、フルオロホアまたは細胞懸濁液の溶液は脱酸素することができるが、これは生きた細胞および組織にとっては実現可能ではない。 おそらく、光退色に対する最良の保護は、蛍光色素の露出を強烈な照明(中性密度フィルターを使用)に制限することであり、市販の防汚試薬を適切に使
特定の状況下では、光退色効果を利用して、そうでなければ利用できない特定の情報を得ることもできる。
特定の状況下では、光退色効果を利用 例えば、光退色後の蛍光回収(FRAP)実験では、標的領域内の蛍光色素は、過度のレベルの照射で意図的に漂白される。 新しいフルオロフォア分子が試料の漂白領域に拡散すると(回復)、蛍光発光強度が監視され、標的フルオロフォアの横方向拡散速度が決定される。 このようにして、蛍光標識された分子の並進移動度は、単一の細胞または生体組織の切片の非常に小さい(2〜5μ m)領域内で確認することができる。
寄稿著者
Brian Herman-細胞および構造生物学部門、テキサス大学健康科学センター、7703Floyd Curl Drive、San Antonio、Texas78229。
Matthew J.Parry-Hill,Ian D.Johnson,And Michael W.Davidson-National High Magnetic Field Laboratory,1800East Paul Dirac Dr.,The Florida State University,Tallahassee,Florida,32310.
蛍光導入に戻る
蛍光顕微鏡に戻る
質問やコメントは? 私達に電子メールを送って下さい。
デイビッドソンとフロリダ州立大学。 すべての権利を保有します。 いかなる画像、グラフィック、スクリプト、アプレットも、著作権者の許可なく複製または使用することはできません。 このウェブサイトの使用は、あなたが所有者によって定められた法的条件のすべてに同意することを意味します。
このウェブサイトは、私たちの
グラフィックス&ウェブプログラミングチーム
国立高磁場研究所の光学顕微鏡と共同で
。
最終更新日:2016年9月12日月曜日01:58PM
2003年6月10日以降のアクセス数: 116208
![]()
![]()
![]()
![]()