Label:MEGACE ES-megestrol acetate suspension
CLINICAL PHARMACOLOGY
ガスクロマトグラフィー-質量断片化法(GC-MF)、高圧液体クロマトグラフィー(HPLC)、ラジオイムノアッセイ(RIA)など、酢酸メゲストロールの血漿中濃度を推定するために使用されるいくつかの分析方法がある。 GC-MFおよびHPLC方法はmegestrolのアセテートおよび収穫の同等の集中のために特定です。 従ってria方法はmegestrolのアセテートの代謝物質に反応し、非特異的で、GC-MFおよびHPLC方法より高い濃度を示します。 血漿濃度は、使用される方法だけでなく、腸管運動性、腸内細菌、投与される抗生物質、体重、食事および肝機能などの要因によって影響され得る薬物の腸
作用機序
いくつかの研究者は、酢酸メゲストロールの食欲増強特性および悪液質におけるその可能性のある使用について報告している。 Megestrolのアセテートが拒食症および悪液質の効果を作り出す精密なメカニズムは現時点で未知です。
薬物動態学的特性:
625mg(125mg/mL)のMegace®ES経口懸濁液を投与した後の酢酸メゲストロールの血漿濃度は、摂食条件下で酢酸メゲストロール経口懸濁液800mg(40mg/mL)
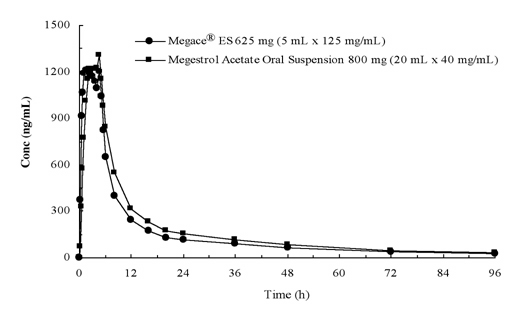
Megace®ESの用量比例性を特徴付けるために、空腹時および摂食条件下で投与した場合、用量の範囲にわたる薬物動態学 Megestrolの薬物動態は、食事の状態にかかわらず、Megace®ES投与後、150mg〜675mgの間の投薬範囲で線形であった。 高脂肪食下のCmaxおよびAUCは、6 2 5mg Megace(登録商標)ES投与後の絶食下のものと比較して、それぞれ4 8%および3 6%増加した(表1)。 しかし、高脂肪食は、元の製剤中の800mgの投与後の絶食条件下のものと比較して、メゲストロールのAUCおよびCmaxをそれぞれ2倍および7倍に有意に増加させた。 摂食状態での投与後の安全性に差はなかったため、食事に関係なくMegace®ESを摂取することができました。
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
酢酸メゲストロールの血漿定常状態薬物動態は、後天性免疫不全症候群(AIDS)とベースラインの10%以上の不随意体重減少 患者は21日間megestrolのアセテートの口頭懸濁液の800mg/dayの単一の口頭線量を受け取りました。 21日目に得られた血漿濃度データを、最後の用量を過ぎて最大48時間にわたって評価した。酢酸メゲストロールの平均(±1SD)ピーク血漿濃度(Cmax)は753(±539)ng/mLであった。
酢酸メゲストロールの平均(±1SD)ピーク血漿濃度(Cmax)は753(±539)ng/mLであった。 濃度時間曲線下の平均面積(AUC)は、1 0 4 7 6(±7 7 8 8)ng×時間/mLであった。 Tmax値の中央値は五時間であった。 10人の患者のうち、三週間で体重が増えた。
さらに、24人の成人、無症候性HIV血清陽性男性被験者に、750mgの酢酸メゲストロール経口懸濁液を毎日一度投与した。 治療は14日間投与した。 平均CmaxおよびAUC値は、それぞれ4 9 0(±2 3 8)ng/mlおよび6 7 7 9(±3 0 4 8)hr×ng/mlであった。 Tmax値の中央値は三時間であった。 平均Cmax値は2 0 2(±1 0 1)ng/mlであった。 変動値の平均%は107(±40)であった。
代謝
尿中に同定された酢酸メゲストロール代謝産物は、投与された用量の5%から8%を構成した。 標識された二酸化炭素および脂肪貯蔵としての呼吸排泄は、尿および糞便中に見出されない放射能の少なくとも一部を占めている可能性がある。
排除
ヒトにおける薬物排除の主要な経路は尿である。 放射性標識された酢酸メゲストロールを4-90mgの用量でヒトに投与した場合、10日以内の尿中排excretionは56.5%から78.4%(平均66.4%)であり、糞便排excretionは7.7%から30.3%(平均19.8%)であった。 回収された総放射能は83.1%から94.7%(平均86.2%)の間で変化した。
特別な集団
酢酸メゲストロールの薬物動態は、特別な集団では研究されていない。
動物薬理学および/または毒性学
Megace®ES(megestrol acetate)による長期治療は、呼吸器感染症のリスクを高める可能性があります。 ラットを用いた酢酸メゲストロールの慢性毒性/発癌性研究では,呼吸器感染症の頻度の増加,リンパ球数の減少および好中球数の増加の傾向が観察された。
臨床試験の説明
800mg/20mLの用量での酢酸メゲストロール経口懸濁液は、625mg/5mLのMegace®ESに相当する。 酢酸メゲストロール経口懸濁液の臨床的有効性は、二つの臨床試験で評価されました。 1つは、食欲不振/悪液質および有意な体重減少を有するAIDS患者において、1日あたり100mg、400mg、および800mgの用量で酢酸メゲストロール(MA)をプラセボと比較した多施設、無作為化、二重盲検、プラセボ対照試験であった。 試験に参加した270人の患者のうち、195人はすべての包含/除外基準を満たし、12週間にわたって少なくとも二つの追加のベースライン後重量測定を有していたか、または一つのベースライン後重量測定を有していたが、治療上の失敗のために脱落した。 12週間の研究で最大体重増加時に5ポンド以上を獲得した患者の割合は、800mg(64%)および400mg(57%)のMA治療群でプラセボ群(24%)よりも統計的に有意に大きかった。 平均体重は、ベースラインから最後の評価まで、12の研究週間で800mg MA治療群で7までに増加した。8ポンド、4.2ポンドによる400mg MAのグループ、1.9ポンドによる100mg MAのグループおよび偽薬のグループで1.6ポンド減りました。 二つの臨床試験における有効性のために評価可能な患者のための4、8および12週間での平均体重変化は、グラフィカルに示されています。 生体電気インピーダンス分析によって測定された12週間の試験中の体組成の変化は、MA処理群における非水分体重の増加を示した(臨床試験表を参照)。 さらに、浮腫はわずか3人の患者で発症または悪化した。
800mg群(89%)、400mg群(68%)および100mg群(72%)のMA治療患者の割合がプラセボ群(50%)よりも高く、12週間の試験中の最後の評価で食欲の改善を示した。 統計的に有意な相違はベースラインからの最高の重量の変更の時間へのカロリー摂取量の変更の800mg MA扱われたグループと偽薬のグループの間で観察され 患者は、9質問調査で体重変化、食欲、外観、および幸福の全体的な認識を評価するように求められた。 最大体重変化時には、800mgのMA治療群のみが、プラセボ治療群と比較して、すべての質問に対して統計的に有意に良好な応答を示した。 用量応答は、すべての質問のためのより高い用量と相関する肯定的な応答との調査で認められた。
第二の試験は、食欲不振/悪液質および有意な体重減少を有するAIDS患者における酢酸メゲストロール800mg/日対プラセボを比較した多施設、無作為化、二重盲検、プラセボ対照試験であった。 試験に参加した100人の患者のうち、65人はすべての包含/除外基準を満たし、12週間にわたって少なくとも二つの追加のベースライン後重量測定を有していたか、または一つのベースライン後重量測定を有していたが、治療上の失敗のために脱落した。 800mgのMA処置されたグループの患者は偽薬のグループの患者より平均最高の重量の変更の統計的にかなり大きい増加がありました。 ベースラインから第12週までの平均体重は、MA治療群では11.2ポンド増加し、プラセボ群では2.1ポンド減少した。 生体電気インピーダンス分析によって測定された体組成の変化は、MA処理群で非水重量の増加を示した(臨床試験表を参照)。 MA投与群では浮腫は報告されなかった。 プラセボ治療患者(38%)よりもMA治療患者(67%)の大きな割合は、12の研究週間の間に最後の評価で食欲の改善を示した;この差は統計的に有意であった。 平均カロリー変化または最大体重変化までの時間における毎日のカロリー摂取量には、治療群間に統計的に有意な差はなかった。 最初の試験で参照された同じ9質問調査では、体重変化、食欲、外観、および幸福の全体的な認識の患者の評価は、プラセボ群と比較してMA治療患者の平均ス
いずれの試験においても、患者は薬物を良好に許容し、実験室異常、新しい日和見感染、リンパ球数、T4数、T8数、または皮膚反応性試験に関して、治療群間に統計的に有意な差は見られなかった(ADVERSEREACTIONSのセクションを参照)。
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.