Moleculaire Uitdrukkingen Microscopie Primer: Fluorescentie – Photobleaching – Interactieve Tutorial
- Fluorescentie Microscopie Interactieve Tutorials
- Photobleaching
- vragen of opmerkingen? Stuur ons een email.
- © 1998-2021 door Michael W. Davidson en de Florida State University. Alle Rechten Voorbehouden. Geen afbeeldingen, afbeeldingen, scripts of applets mogen worden gereproduceerd of gebruikt op welke manier dan ook zonder toestemming van de houders van het auteursrecht. Gebruik van deze website betekent dat u akkoord gaat met alle van de wettelijke voorwaarden die door de eigenaren.
- deze website wordt onderhouden door onsGraphics & Web Programming TeamIn samenwerking met optische microscopie van hetNational High Magnetic Field Laboratory.
- laatste wijziging: maandag 12 Sep 2016 om 01: 58
- Aantal toegang sinds 10 juni 2003: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
Fluorescentie Microscopie Interactieve Tutorials
Photobleaching
Het fenomeen van photobleaching (ook vaak aangeduid als fading) treedt op wanneer een fluorofoor permanent verliest het vermogen om te fluoresceren door foton-geïnduceerde chemische schade en covalente modificatie. Op overgang van een opgewekte singletstaat aan de opgewekte tripletstaat, kan fluorophores met een andere molecule in wisselwerking staan om onomkeerbare covalente wijzigingen te veroorzaken. De tripletstaat is relatief lang-geleefd met betrekking tot de singletstaat, waarbij opgewekte molecules een veel langer tijdsbestek worden toegestaan om chemische reacties met componenten in het milieu te ondergaan. Het gemiddelde aantal opwinding en emissiecycli die voor een bepaalde fluorophore vóór photobleaching voorkomen is afhankelijk van de moleculaire structuur en het lokale milieu. Sommige fluorophores bleekmiddel snel na het uitzenden van slechts een paar fotonen, terwijl anderen die robuuster zijn duizenden of miljoenen cycli kunnen ondergaan alvorens te bleken. Deze interactieve tutorial onderzoekt variaties in photobleaching tarieven in enkele, dubbele, en vermenigvuldigen geëtiketteerde fluorescentie specimens.
de tutorial initialiseert met een paar identieke fluorescentiebeelden die verschijnen in de ongebleekte afbeelding en de gebleekte afbeelding vensters. Om de tutorial te bedienen, klikt u op de sluiterknop om de virtuele sluiter te openen en de Fotogebleekte afbeelding te laten vervagen of photobleach met een sterk overdreven snelheid over een vaste periode. Fading kan worden gestopt op elk punt door te klikken op de pauze-knop (die een Start-knop wordt), en vervolgens hervat door te klikken op de Start-knop. In dubbele en drievoudige geëtiketteerde specimens, kunnen de diverse individuele fluorophore het bleken tarieven individueel worden bekeken gebruikend de selectievakjes van Kleurenkanalen (de standaardinstelling is alle kanalen ingeschakeld). Als u bijvoorbeeld op het Rode selectievakje klikt voor een exemplaar met drievoudige etikettering, wordt alleen het Rode kleurenkanaal weergegeven. Twee of alle drie de kleurkanalen kunnen met het selectievakje Toevoegen worden gemengd in samples met vermenigvuldigingsetiketten. Een nieuw specimen kan worden geselecteerd met behulp van het keuzemenu een Specimen kiezen. Specimennamen omvatten de volgende fluorophore etiketteringsinformatie: FITC, fluoresceïne isothiocyanate; drievoudige, een rode, groene, en blauwe fluorophore; Dual, twee fluorophores; DAPI, 4′, 6-diamidino-2-phenylindole; MitoTracker, een mitochondrial sonde; Alexa 488, een groene fluorophore; en Auto, autofluorescentie. De tutorial wordt ontworpen om photobleaching tarieven voor individuele fluorophores op het herladen willekeurig te veranderen, zodat het klikken op de sluiterknop herhaaldelijk zal demonstreren hoe het beeld verschijnt als de veranderingen van de fluorescentie het bleken tarief voor elk van de kleursignalen.
omdat photobleaching, een zeer slecht begrepen fenomeen, leidt tot een dramatisch verlies van fluorescentie-emissie-intensiteit in de meeste specimens, is het beheersen van het artefact van cruciaal belang om met succes bevredigende beelden vast te leggen. Als voorbeeld voor een typisch fluorochroom, dicteert de kwantumopbrengst voor het photobleaching van fluoresceïne bij gemiddelde tot hoge verlichtingsintensiteit dat een gemiddelde molecuul tussen 30 tot 40 duizend fotonen tijdens zijn nuttige levensduur (alvorens permanent onbruikbaar te worden) zal uitzenden. Bovendien is het aantal opwinding en emissiecycli constant voor een bepaalde fluorophore ongeacht hoe de opwindingsenergie, of in discrete impulsen of door ononderbroken verlichting wordt geleverd. Daarom, vermindert het verminderen van het opwindingslichtniveau door neutrale dichtheidsfilters te gebruiken photobleaching niet, vermindert het slechts het tarief.
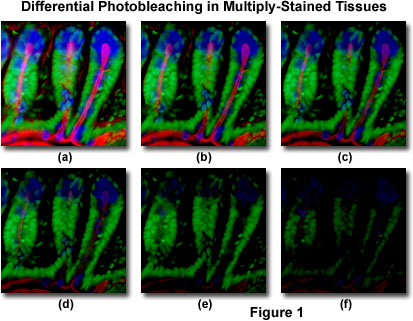
in Figuur 1 is een typisch voorbeeld van fotobleaching (fading) waargenomen in een reeks digitale beelden die op verschillende tijdstippen zijn vastgelegd voor een multi-gekleurde cryostaatdunne sectie (16 micrometer) van de darm van de muis. De kernen werden gekleurd met Sytox Green (groene fluorescentie), terwijl het slijm van kelk cellen en de filamenteuze actin in de borstelgrens werden gekleurd met Alexa Fluor 350 tarwekiem agglutinine (blauwe fluorescentie) en Alexa Fluor 568 phalloidin (rode fluorescentie), respectievelijk. De tijdpunten werden genomen in twee minuten intervallen gebruikend een fluorescentiefiltercombinatie met bandbreedtes die worden afgestemd om drie fluorophores gelijktijdig op te wekken terwijl ook het registreren van de gecombineerde emissiesignalen. Merk op dat alle drie fluorophores een vrij hoge intensiteit in Figuur 1(A) hebben, maar de intensiteiten Alexa Fluor 350 en 568 (blauw en rood) beginnen snel bij twee minuten te dalen en zijn bijna volledig verdwenen bij zes minuten. De groen gekleurde kernen zijn beter bestand tegen fotobleaching, maar hun intensiteit daalt ook gestaag in de loop van de getimede sequentie (10 minuten). Een grote verscheidenheid van synthetische antifade reagentia zal de snelheid van het photobleaching aanzienlijk verminderen.
een belangrijke klasse van fotobleaching events is fotodynamisch, wat betekent dat ze de interactie van de fluorofoor met een combinatie van licht en zuurstof impliceren. De reacties tussen fluorophores en moleculaire zuurstof vernietigen permanent fluorescentie en brengen een vrije radicale singlet zuurstofspecies op die andere molecules in levende cellen chemisch kunnen wijzigen. De hoeveelheid photobleaching toe te schrijven aan photodynamic gebeurtenissen is een functie van de moleculaire zuurstofconcentratie en de proximale afstand tussen fluorophore, zuurstofmolecules, en andere cellulaire componenten. Het Photobleaching kan worden verminderd door de blootstellingstijd van fluorophores aan verlichting te beperken of door de opwindingsenergie te verlagen. Nochtans, verminderen deze technieken ook het meetbare fluorescentiesignaal. In veel gevallen, kunnen de oplossingen van fluorophores of celsuspensies worden gedeoxygeneerd, maar dit is niet haalbaar voor het leven cellen en weefsels. Misschien is de beste bescherming tegen photobleaching het beperken van de blootstelling van het fluorochroom aan intense verlichting (met behulp van neutrale dichtheidsfilters) in combinatie met het oordeelkundige gebruik van in de handel verkrijgbare antifade reagentia die kunnen worden toegevoegd aan de montageoplossing of celkweekmedium.
onder bepaalde omstandigheden kan het fotobleaching-effect ook worden gebruikt om specifieke informatie te verkrijgen die anders niet beschikbaar zou zijn. Bijvoorbeeld, in fluorescentieterugwinning na photobleaching (FRAP) experimenten, worden fluorophores binnen een doelgebied opzettelijk gebleekt met bovenmatige niveaus van bestraling. Aangezien de nieuwe fluorophore molecules in het gebleekte gebied van het specimen (terugwinning) verspreiden, wordt de intensiteit van de fluorescentieemissie gecontroleerd om de zijverspreidingstarieven van doelfluorophore te bepalen. Op deze manier, kan de translationele mobiliteit van fluorescently geëtiketteerde molecules binnen een zeer klein (2 tot 5 micrometer) gebied van een enkele cel of sectie van levend weefsel worden vastgesteld.
bijdragende auteurs
Brian Herman-Department of Cellular and Structural Biology, University of Texas Health Science Center, 7703 Floyd Curl Drive, San Antonio, Texas 78229.Matthew J. Parry-Hill, Ian D. Johnson, and Michael W. Davidson-National High Magnetic Field Laboratory, 1800 East Paul Dirac Dr., the Florida State University, Tallahassee, Florida, 32310.
terug naar fluorescentie inleiding
terug naar fluorescentiemicroscopie
vragen of opmerkingen? Stuur ons een email.
© 1998-2021 door Michael W. Davidson en de Florida State University. Alle Rechten Voorbehouden. Geen afbeeldingen, afbeeldingen, scripts of applets mogen worden gereproduceerd of gebruikt op welke manier dan ook zonder toestemming van de houders van het auteursrecht. Gebruik van deze website betekent dat u akkoord gaat met alle van de wettelijke voorwaarden die door de eigenaren.
deze website wordt onderhouden door ons
Graphics & Web Programming Team
In samenwerking met optische microscopie van het
National High Magnetic Field Laboratory.
laatste wijziging: maandag 12 Sep 2016 om 01: 58
Aantal toegang sinds 10 juni 2003: 116208
![]()
![]()
![]()
![]()