Grenser I Kjemi
- Introduksjon
- Materialer og Metoder
- Materialer
- Cellekultur
- Prism-Baserte SPR – Bildeoppsett
- Sensor Chip Forberedelse
- Flow System
- Følsomhetskalibrering
- Resultater og Diskusjon
- Innledende Massetetthetstap I Cellefiksering ved PFA
- Osmotisk Trykkrespons I Cellefiksering av PFA
- Betydelig Massetetthet Tap I Celle Permeabilization Av Triton
- Konklusjon
- Forfatterbidrag
- Interessekonflikt
- Takk
Introduksjon
Immunofluorescens Er en kraftig teknikk for å visualisere fordelingen av spesifikke biomolekyler i biologiske prøver som celler og vev (Joshi og Yu, 2017). I typiske cellebaserte immunfluorescerende analyser ble adherente celler inkubert med fluorescerende antistoff for å muliggjøre spesifikk anerkjennelse og binding mellom antistoffet og målmolekylet i cellene. Etter grundig skylling ble prøven plassert under fluorescensmikroskop for å oppnå et fluorescensbilde, hvorfra fordelingen av målmolekyler ble rapportert av fluorescerende koder. For å lette tilgjengeligheten av antistoff til målmolekylene og for å hemme den iboende cellulære aktiviteten, ble prøvene ofte faste og permeabiliserte før fargingsprosedyrene. De var spesielt nødvendige når målmolekylene var lokalisert i cytoplasma. Blant mange typer reagenser er paraformaldehyd (PFA) og Triton X-100 trolig de mest brukte for fiksering og permeabilisering, henholdsvis. Depolymerisering av PFA produserte formaldehydmolekyler for å skape kovalente kjemiske bindinger mellom proteiner i prøven. Virkningsmekanismen stod på aktiveringen av en av aminosyrerester lysin. PFA også oppløst noen lipider i cellemembraner som litt skadet cellemembranen integritet (Fox et al., 1985; Thavarajah et al.(2012; Kiernan, 2018). Triton X-100, som et effektivt ikke-ionisk vaskemiddel, kunne oppløse lipider fra cellemembraner, slik at cellemembranen ble mer permeabel for det fluorescerende antistoffet. Permeabiliseringstrinnet fjernet flere cellulære membranlipider på grunn av dets uladede, hydrofile hodegrupper som består av polyoksyetylengrupper for å tillate store molekyler som antistoffer å komme inn i cellen (Jamur og Oliver, 2010; Koley og Bard, 2010). En skjematisk illustrasjon av celle fiksering og permeabilization prosessen er vist I Figur 1D. Til tross for det faktum at fiksering og permeabilisering har blitt rutinemessige prosedyrer i immunfluorescens og immunhistokjemi, har det blitt gjort ganske sjeldne forsøk på kvantitativt å klargjøre deres påvirkning på membranintegriteten og cellulær massetetthet på enkeltcellenivå.
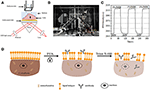
Figur 1. Prism-baserte SPR imaging oppsett. (A) Skjematisk illustrasjon av eksperimentell oppsett. (B) et bilde av apparatet. (C) Følsomhetskalibreringskurve. (D) Skjematisk illustrasjon av cellefiksering og permeabilisering.Overflate plasmon resonans (SPR) har vært en populær og kraftig teknikk for å bestemme bindingskinetikken mellom et par molekyler siden oppfinnelsen i 1980s (Liedberg et al., 1983; Cullen et al., 1987). Dette tilskrives sine bemerkelsesverdige fordeler, inkludert sanntids kvantitativ kinetisk måling med høye temporale oppløsninger, kompatibilitet med utvidede enheter ,og viktigst av alt, dets iboende funksjon av etikettfri (Rotenhenhusler Og Knoll, 1988; Phillips og Cheng, 2007; Homola, 2008; Abadian et al., 2014; Mé et al., 2014; Yanase et al., 2014; Su Og Wang, 2018). Tidlige applikasjoner fokuserte hovedsakelig på å karakterisere og kvantifisere biomolekylære interaksjoner ved å immobilisere rensede molekyler på SPR-sensing-substrater (gullbelagte glassglass). Slike ex situ-studier krevde ikke bare arbeidsintensive renseprosedyrer, men førte også til resultater som kanskje ikke gjenspeiler den naturlige samspillet i levende vesener (Phillips og Cheng, 2007; Homola, 2008). Drevet av både den tekniske utviklingen i ULIKE SPR imaging (SPRi) systemer og den vitenskapelige motivasjonen i single cell imaging og analyse, har både prisme og objektiv-baserte SPRi teknikker vært ansatt for å avbilde massedistribusjon av enkelt levende celler uten behov for merking(Wang et al ., 2010, 2012a; Yanase et al., 2010; Jan et al., 2015; Zhang et al., 2015). Hver har sine egne fordeler. Sistnevnte har høyere romlige oppløsninger, og den tidligere har en bedre følsomhet. Ved å overvåke tidsavbrudd SPR bilder av enkelt levende celler under ulike typer fysiologiske og biologiske stimuleringer, viktig romlig og dynamisk informasjon om celle-substrat interaksjoner (Giebel et al ., 1999), cell migrations (Smith et al., 2004), osmotiske reaksjoner (Wang et al., 2012a), ligand-reseptorbindende kinetikk (Wang et al., 2012b, 2014), signalveier (Deng et al., 2016), proteinaktiveringsdynamikk (Peng et al., 2018), og levende kreftcellemedisinresponser (Wang et al., 2018) har blitt oppnådd. For tilfeller, eksisterende studier har tydelig vist At SPRi teknikker var i stand til å kartlegge massetetthet samt membran integritet på enkelt celle nivå (Yanase et al., 2010; Wang et al., 2012b; Jan et al., 2015). SPRi ‘ s bildekontrast kom fra den subcellulære fordeling av brytningsindeksen, som grovt ble bestemt av den lokale massetettheten. Binding av spesifikke antistoffer på cellemembranen som uttrykte de tilsvarende antigener, eller stimulere levende celler med spesielle kjemikalier, ble funnet å endre massetettheten av enkeltceller i en heterogen og dynamisk måte (Wang et al., 2012a, b). Eksponering av enkelt levende celler til hypertoniske løsninger ble funnet å indusere sammentrekning av celler, noe som indikerer den utmerkede integriteten til cellemembraner (Wang et al.( 2012a). Men hvordan fikserings-og permeabiliseringsbehandlingene vil påvirke SPR-bildene av enkeltceller, er fortsatt uklart.
i det nåværende arbeidet brukte vi et hjemmebygget SPRi-system for kontinuerlig å registrere tidsavbrudd SPR-bilder av titalls enkelt levende celler når cellene ble suksessivt behandlet med 4% PFA-løsning og 1% Triton X-100-løsning. Massetettheten av enkeltceller ble bestemt av det gjennomsnittlige SPRi-signalet. Membranintegriteten ble evaluert ved å utsette cellene for hypertonisk løsning. Det ble funnet at I tillegg til den litt reduserte massetettheten ved <10%, ødela PFA-behandling signifikant celleintegriteten som indikert ved tap av osmotisk respons ved eksponering av sukkermolekyler. Etterfølgende behandling Med Triton X-100 reduserte imidlertid massetettheten betydelig med ytterligere 20%, noe som tyder på alvorlig ødeleggelse av membranets integritet.
Materialer og Metoder
Materialer
Dulbecco fosfatbufret saltvann (PBS, Gibco), Sukrose (Sinopharm Kjemisk Reagens Co., Ltd), Triton X-100 (Aladdin), Paraformaldehyd (Shanghai Lingfeng Kjemisk Reagens Co.(Ltd). Alle reagensene ble oppløst I PBS.
Cellekultur
BT-474-celler ble dyrket ved 37°C med 5% CO2 og 70% relativ fuktighet i Dubelcos Modifiserte Eagle-Medium (DMEM, Invitrogen) med 10% føtalt bovint serum (FBS, Invitrogen), 100 enheter/mL penicillin og 100 µ / mL streptomycin (Invitrogen). Celler ble passert når de var 70-80% konfluent ved behandling med 0,25% trypsin løsning (Gibco).
Prism-Baserte SPR – Bildeoppsett
et skjematisk diagram og et bilde av SPRi-systemet er presentert I Figur 1A, B. SPRi-apparatet består hovedsakelig av tre deler: lyskilde, optiske komponenter og kamera.
• Lyskilde: en 670 nm lysemitterende diode (L7868-01, Hamamatsu, Japan) og en temperaturkontrollert monteringskontakt (LDM21, Thorlabs, Newton, USA).
• Optiske komponenter (Edmund Optics, USA): et trekant sf-11 prisme med en sensorbrikke på (Nr . 1 bk7 glass Fra Fisherbrand), en konvergerende linse, en polarisator og en justerbar linse.
• Kamera: Kamera Med Ladekobling (Pike F032B, Allied Vision Technology, Newburyport, USA).det p-polariserte lyset treffer bunnen av det gullbelagte glassglasset direkte gjennom prismen, og kameraet fanger den reflekterte strålen for å generere SPR-bilder med en hastighet på 0,828 Bilde per sekund (fps). Ved valg AV 4x forstørrelse i en tunbar linse var synsfeltet ~2 × 2 mm2.
Sensor Chip Forberedelse
Hver chip ble vasket med 75% etanol og deionisert vann (DIW), etterfulgt AV UV-eksponering i 30 min for å fjerne overflateforurensning og sterilisere dem før hvert eksperiment. Et Flexi-Perm silisiumkammer (Greiner Bio-One) ble plassert på toppen av gullbrikken for å tjene som en cellekulturbrønn. For å oppnå overflatemodifikasjonen før cellesåing ble det tilsatt en 100 µ/mL 150 µ kollagenoppløsning i kammeret og holdt i en inkubator i 2 timer. brikken ble deretter skyllet med avionisert vann to ganger og DMEM to ganger før cellesåing. For å gjøre cellene en god form, brikken ble inkubert i vekstmediet for 36 h. vekstmediet ble deretter erstattet MED PBS bufferløsning for 10 min for celler å oppnå en balanse.
Flow System
et gravitasjonsdrevet flerkanals legemiddelperfusjonssystem ble påført injeksjon og bytte av løsningen. Strømningshastigheten er 300 µ / min, og løsningsbryteren rundt cellene kan nå 1-2 s.
Følsomhetskalibrering
en sensorbrikke ble fremstilt som beskrevet i foregående del uten overflatemodifisering og cellesåing. Først strømmet DIW over brikken i ca 60 s. deretter ble den erstattet av 1% (v/v) etanolløsning for en annen 60 s. som en av de mest brukte kalibreringsløsningen er 1% etanol kjent for å øke SPR-vinkelen TIL DIW med 60 mDeg. Eksperimentelle resultater viste at SPR-intensiteten økte tilsvarende med 96 Ie (Figur 1c), tilsvarende en følsomhet på 1,6 Δ.U. / mDeg.
Resultater og Diskusjon
cellemembranen (også kjent som cytoplasmisk membran), som består av et lipid-dobbeltlag med innebygde proteiner, er en semipermeabel membran som omslutter cytoplasma av en celle. Fikserings-og permeabiliseringstrinnene til celler og vevsprøver, som kan endre permeabiliteten til cellemembranen, er avgjørende prosedyrer som kan bestemme suksessene for immunfluorescerende eller immunhistokjemiske analyser. I tillegg til dette er antistoffkvaliteten og immunoreaksjonsprosedyren andre viktige determinanter for slike eksperimenter. SPR har funksjonen at både resonansvinkelen og brytningsindeksen (RI) nær sensingoverflaten er svært følsomme for massetettheten til overflatelaget i mellommetallgrensesnittet. Derfor kan cellens massetetthetsvariasjoner som finner sted på eller nær metallfilmen (~200 nm) registreres synkront ved å måle intensiteten til det reflekterte lyset. Ved å bruke overflate plasmon resonans imaging teknikk, utforsket vi dynamisk fordeling av cellulær massetetthet med høye romlige og tidsmessige oppløsninger og pålitelig følsomhet i både fiksering og permeabilization prosesser i denne studien.
Innledende Massetetthetstap I Cellefiksering ved PFA
det første trinnet for å fremstille biologiske prøver for immunfluorescerende eller immunhistokjemisk analyse er vanligvis fiksering. Og de mest brukte fikseringsmidler for slike analyser er tverrbindende fikseringsmidler som PFA som fungerer ved å generere kovalente kjemiske bindinger mellom proteiner i celler eller vev. Vi undersøkte derfor PÅVIRKNING AV PFA-behandling på cellulær massetetthet. Levende bt-474-celler ble dyrket på deksel belagt med gullfilm med en tykkelse på 50 nm. Et representativt spr-bilde som inneholder enkeltceller er gitt I Figur 2A. SPR-signaler fra hver celle kan oppnås ved å velge en region-av-interesse i SPR-bildet som samsvarer med morfologien til den undersøkte cellen. I et typisk eksperiment, da løsningen strømmet over cellene, BLE SPR sensorgrams av cellene oppnådd ved å analysere hver celle som vist I Figur 2b (svart kurve). I de foregående 242 s strømmet PBS-bufferen uten PFA over cellene, og baseline ble bestemt av systemstabiliteten (lyskilde og mekanisk stabilitet) og de iboende mikromotionsignalene generert av levende celler. PFA-løsningen ble deretter introdusert på 242th sekund, som umiddelbart økte SPR-signalet på grunn av den relativt store brytningsindeksen på 4% pfa-løsning (bulk effect). PFA-løsningen løp i ytterligere 17 minutter for å oppnå tilstrekkelig fiksering. Ved 1237th sekund ble PFA-løsningen byttet tilbake til ren PBS-løsning. I tillegg til den reduserte bulkeffekten ble det funnet en reduksjon I SPR-intensiteten til enkeltceller ved sammenligning av signalene før (0-242) og etter (1237-1545) PFA-behandlingene og massetapsprosenten ble oppnådd ved å dele reduksjonsverdien til den opprinnelige verdien. Spr sensongrams av bakgrunnen (en tilstøtende region uten celleadhesjon, blå kurve) og en enkelt celle behandlet MED PBS under 1500 s (grå kurve) er også vist I Figur 2B. Statistisk analyse på 30 celler viser et gjennomsnittlig massetetthetstap på 10 ± 5% som vist I Figur 2c. Det ble også funnet at etter PFA-behandling ble baseline svingningsnivået I SPR-signal signifikant redusert med halv eller til og med to tredjedeler, noe som tyder på tap av mikromotioner og fiksering av de behandlede cellene som vist I Figur 2D. Slike mikromotionsignaler ble generert av en haug med dynamiske cellulære aktiviteter fra forskjellige cellekomponenter, inkludert skjelett, membraner og organeller. Fikseringen avsluttet slike biologiske aktiviteter og eliminerte derfor mikromotionsignalene, som fulgte med en betydelig redusert intensitetsfluktuasjon I SPR-sensogrammer av enkeltceller.
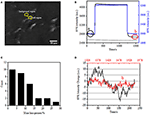
Figur 2. Celle fiksering prosess. (A) SPRi bilde AV BT-474 celler. (B) SPR-signaler av enkeltcelle (svart kurve) og bakgrunn (blå kurve) som gjennomgår en løsningsbryterprosess: PBS-buffer til 4% PFA TIL PBS-buffer. SPR signal av enkeltcelle behandlet MED PBS under 1500 s (grå kurve). (C) Massetapsfordeling av 30 enkeltceller. (D) Støynivå av cellen før (a) og etter (b) PFA behandling.
Osmotisk Trykkrespons I Cellefiksering av PFA
den integrerte strukturen av cellemembran, en semi-permeabel membran, regulerer homeostasen til en celle for å nå balanse i fysiologisk osmotisk trykk. PFA-behandling ble også funnet å ha evnen til å ødelegge membranintegriteten som vist i Figur 3. Når bufferen rundt målcellen endret seg til 25 mM sukroseoppløsning i < 1 s via et legemiddelperfusjonssystem, ble det opprettet et hypertonisk cellekulturmiljø. For levende celler utløste eksponeringen for hypertonisk løsning en rekke fysiologiske responser for å balansere det intracellulære og ekstracellulære osmotiske trykket, som har blitt undersøkt i detaljer i vårt tidligere arbeid (Wang et al.( 2012a). I denne studien er et typisk SPR-sensorgram av enkelt fysiologiske bt-474-celler gitt I Figur 3A. ved eksponering for hypertonisk sukroseoppløsning gjennomgikk behandlede celler først en pressende krympe, noe som førte til en gradvis økning I SPR-intensitet til et platå ble nådd. Det foreslo den økte massetettheten som følge av cellekrymping og subcellulære komponenter som samler seg mot bunnen av gullkulturens deksel. Den gradvise økningen I SPR-intensitet ved hypertonisk stimulering er en slags fysiologisk regulering for cellulært osmotisk trykk, og indikerer dermed den fysiologiske integriteten til cellemembranen. Når membranintegriteten ble ødelagt, ble innføringen av hypertonisk sukroseoppløsning funnet å umiddelbart øke SPR-intensiteten på en mye kortere tid, som vist I Figur 3B. Det er fordi sukkermolekylene fritt trengte inn i cellene uten motstand fra den semi-permeable membranen og økte den lokale brytningsindeksen umiddelbart (bulkeffekt). Det er klart at mens den langsomme økningen i SPR-intensiteten reflekterte den fysiologiske osmotiske reguleringen (Figur 3A), viste det raske hoppet at cellemembranen hadde blitt skadet for å tillate fri oppføring av små sukkermolekyler (Figur 3B).

Figur 3. Osmotiske trykkresponser av celler. (A) Respons av en levende celle til 25 mM sukrose. (B) Respons av samme celle fast (10 min) til 25 mM sukrose.
Betydelig Massetetthet Tap I Celle Permeabilization Av Triton
i forrige fiksering scenen, en innledende celle massetetthet redusert bare med ~10% (Figur 2c). Det er rimelig å spekulere på AT pfa-fikseringen bare ødela membranintegriteten litt og økte permeabiliteten til små molekyler. Flertallet av de intracellulære komponentene skal fortsatt være i cytoplasmisk membran. Vi studerte deretter innflytelsen av et typisk permeabiliseringsvaskemiddel, 1% Triton X-100, på celler som har blitt løst MED PFA i 17 min tidligere. Et representativt spr-sensorgram av enkeltceller under eksponering for 1% Triton X-100 er vist I Figur 4A. innføringen Av Triton X-100 økte SPR-intensiteten etterfulgt av en gradvis reduksjon. Den første økningen er en konsekvens av å øke brytningsindeksen for bulkløsning, og den etterfølgende reduksjonen indikerte det gradvise tapet i massetettheten på grunn av cellepermabiliseringen. Den reduserte massetettheten var mer rikelig når man sammenlignet spr-intensitetsendringen før (0-300 s) og etter innføring av vaskemiddel (1,300–1,800 s). Analyse på 30 enkeltceller viste at Triton X-100-behandlingen ga en betydelig reduksjon i massetettheten med ytterligere 20 ± 5% etter PFA-fiksering som vist I Figur 4D Og Tabell 1. Det er klart at vaskemiddelet Triton X-100 eliminerte mye mer cellulære membranlipider og alvorlig ødela membranintegriteten i dette permeabiliseringsstadiet. Dette resulterte i flere intracellulære komponenter, spesielt makromolekyler, for å frigjøre fra cellene. Og dette tillater også store molekyler som antistoffer å komme inn i cellen i neste immunoreaksjonsstadium. SELV OM SPR intensitet av små molekyler utvasking ble påvist etter pfa fiksering, permeabilization ved Hjelp Av triton X-100 vaskemiddel klart oppløselig lipider og gjort cellene mye mer permeable for bevegelser av makromolekyler inn og ut av cellekroppen.
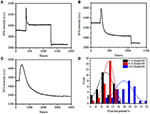
Figur 4. Massetapskurver av celle behandlet med forskjellige konsentrasjonsløsninger (A) 1,0%, (B) 0,5%, (C) 0,1%. (D) massetapsfordeling av 30 enkeltceller under forskjellige forhold.

Tabell 1. Et sammendrag av variasjoner i massetetthetstap av statistiske celler under forskjellige forhold.
det ble funnet at tapet i massetetthet er en ganske rask prosess, som skjedde om noen få minutter i permeabiliseringsstadiet (Figur 4A). Nedgangen i massetetthet fulgte omtrent et monotonisk forfall innen en tidsperiode på 126 s.de typiske sensorgrams av enkeltceller under 0,5 og 0,1% Triton X-100 vises i Henholdsvis 4b,C. Permeabiliseringsprosessen ble mye langsommere når man reduserte konsentrasjonen av vaskemiddel. Det tok 126, 510, 2600 s for de tre typene av de behandlede cellene for å fullføre massetap.
Konklusjon
i sammendraget har dynamisk omfordeling av cellulær massetetthet i både fikserings-og permeabiliseringsprosesser blitt utforsket sensitivt ved å bruke prismebasert SPRi-oppsett med høye romlige og tidsmessige oppløsninger. Fiksativ PFA kan i utgangspunktet øke permeabiliteten til cytoplasmisk membran til en viss grad fordi dens evne til å fikse cellulære proteiner i både membran og intracellulære proteiner. Det ble støttet av (1) den reduserte massetettheten med ~10% etter en 17-min fikseringsbehandling i 4% PFA-løsning, og (2) den eliminerte cellulære responsen på hypertonisk løsning, som viste ødeleggelse av cellulær integritet til små molekyler som sukkerarter. Vaskemiddel Triton X-100 er bedre enn fikserende PFA i oppløsende lipider og dermed økende cellemembranpermeabilitet, som følger med det større tapet i massetettheten på grunn av frigjøring av ikke bare små molekyler, men også store molekyler og muligens noen organeller som vesikler. Dessuten er frekvensen av massetap positivt korrelert Med Triton X-100 konsentrasjon. Disse resultatene ga kvantitative og dynamiske forståelser av påvirkning av fiksering og permeabilisering på cellulær massetetthet og membranintegritet, med implikasjoner for optimalisering av betingelsene for biologiske eksperimenter med enkeltceller, som immunfluorescerende og immunhistokjemiske analyser.
Forfatterbidrag
RC, Y-WS og WW designet forsøkene. RC, FZ, ML og XW utførte forsøkene. RC, Y-WS og WW skrev avisen. RC, FZ, Y-WS og WW diskuterte resultatene og analyserte dataene.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
håndteringsredaktøren erklærte en felles tilknytning, men ikke noe annet samarbeid, med forfatterne WW, RC, ML og XW ved gjennomgang.
Takk
vi takker økonomisk støtte fra National Natural Science Foundation Of China (Grant No. 21522503).
Abadian, P. N., Kelley, C. P., Og Goluch, E. D. (2014). Cellular analyse og deteksjon ved hjelp av overflate plasmon resonans teknikker. Anal. Chem. 86, 2799–2812. doi: 10.1021/ac500135s
PubMed Abstract | CrossRef Full Text | Google Scholar
Cullen, D. C., Brown, R. G. W., Og Lowe, C. R. (1987). Påvisning av immuno-kompleks formasjon via overflate plasmon resonans på gullbelagte diffraksjon gitter. Biosensorer 3, 211-225. doi: 10.1016/0265-928X (87) 85002-2
PubMed Abstract / CrossRef Full Text / Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., Og Wang, P. (2016). En to-kammer microfluidic enhet for langsiktig levende celle deteksjon basert på overflaten plasmon resonans. Biomicrofluidics 10: 044109. doi: 10.1063/1.4960487
PubMed Abstract | CrossRef Full Text | Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J., Og Roller, P. P. (1985). Formaldehydfiksering. J. Histochem. Cytochem. 33, 845–853. doi: 10.1177/33.8.3894502
PubMed Abstract | CrossRef Full Text | Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Imaging av celle / substrat kontakter av levende celler med overflate plasmon resonans mikroskopi. Biophys. J. 76, 509-516. doi: 10.1016 / S0006-3495 (99)77219-x
PubMed Abstrakt / CrossRef Fulltekst / Google Scholar
Homola, J. (2008). Overflate plasmon resonans sensorer for påvisning av kjemiske og biologiske arter. Chem. Åp 108, 462-493. doi: 10.1021/cr068107d
PubMed Abstract | CrossRef Full Text | Google Scholar
Jamur, M. C., Og Oliver, C. (2010). «Permeabilization av cellemembraner,» I Immunocytokjemiske Metoder Og Protokoller, eds C. Oliver Og M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007 / 978-1-59745-324-0_9
CrossRef Full Text/Google Scholar
Joshi, S., Og Yu, D. (2017). «Kapittel 8-Immunfluorescens», I Grunnleggende Vitenskapsmetoder For Kliniske Forskere, eds M. Jalali, F. Y. L. Saldanha og M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / B978-0-12-803077-6.00008-4
CrossRef Full Text | Google Scholar
Kiernan, J. A. (2018). Formaldehyd, formalin, paraformaldehyd og glutaraldehyd: hva de er og hva de gjør. Micros. I dag 8, 8-13. doi: 10.1017/S1551929500057060
CrossRef Full Text | Google Scholar
Koley, D., Og Bard, A. J. (2010). Triton X-100 konsentrasjonseffekter på membranpermeabilitet av en Enkelt HeLa-celle ved å skanne elektrokjemisk mikroskopi (SECM). Proc. Natl. Acad. Sci. Usa 107, 16783-16787. doi: 10.1073 / pnas.1011614107
PubMed Abstract | CrossRef Full Text/Google Scholar
Liedberg, B., Nylander, C., Og Lunströ, I. (1983). Overflate plasmon resonans for gass deteksjon og biosensing. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Full Text | Google Scholar
Mé, R., Griesser, H. J., Og Thierry, B. (2014). Optisk biosensing for etikettfrie cellestudier. TrAC Trender Anal. Chem. 53, 178–186. doi: 10.1016 / j.trac.2013.08.012
CrossRef Full Text/Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y., Og Li, J. (2018). Etikettfri avbildning av epidermal vekstfaktorreseptor-indusert respons i enkeltlevende celler. Analytiker 143, 5264-5270. doi: 10.1039/C8AN01534A
PubMed Abstract | CrossRef Full Text | Google Scholar
Phillips, Ks, Og Cheng, Q. (2007). Nylige fremskritt i overflateplasmon resonansbaserte teknikker for bioanalyse. Anal. Bioanal. Chem. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract | CrossRef Full Text/Google Scholar
Rothenhuusler, B., Og Knoll, W. (1988). Overflate-plasmon mikroskopi. Natur 332, 615-617. doi: 10.1038/332615a0
Kryssref Fulltekst / Google Scholar
Smith, J. T., Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B., Og Reichert, W. M. (2004). Måling av cellemigrasjon på overflatebundne fibronektingradienter. Langmuir 20, 8279-8286. doi: 10.1021/la0489763
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, Yw, Og Wang, W. (2018). Overflate plasmon resonans sensing: fra rensede biomolekyler til intakte celler. Anal. Bioanal. Chem. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
PubMed Abstract / CrossRef Full Text/Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Og Ranganathan, K. (2012). Kjemiske og fysiske grunnleggende om rutinemessig formaldehydfiksering. J. Oral Maxillofac. Pathol. 16, 400–405. doi: 10.4103/0973-029x.102496
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Etikettfri avbildning, deteksjon og massemåling av enkeltvirus ved overflateplasmonresonans. Proc. Natl. Acad. Sci. U. S. A. 107, 16028-16032. doi: 10.1073 / pnas.1005264107
PubMed Abstract | CrossRef Full Text/Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J., Og Tao, N. (2012a). Kartlegging av enkeltcelle-substratinteraksjoner ved overflateplasmon resonansmikroskopi. Langmuir 28, 13373-13379. doi: 10.1021/la301712h
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, Vj, Liu, Q., Wu, J., et al. (2012b). Etikettfri måling og kartlegging av bindingskinetikk av membranproteiner i enkeltlevende celler. Nat. Chem. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed Abstract | CrossRef Full Text/Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). In situ legemiddelreseptorbindende kinetikk i enkeltceller: en kvantitativ etikettfri studie av antitumorresistens. Sci. Rep. 4: 6609. doi: 10.1038/srep06609
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., Et al. (2018). Ultra-sensitiv og ultra-rask deteksjon av hele umerkede levende kreftcelleresponser på paklitaksel med en grafenbasert biosensor. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016 / j.snb.2018.02.095
CrossRef Full Text/Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., Et al. (2014). Overflate plasmon resonans for cellebasert klinisk diagnose. Sensorer 14, 4948-4959. doi: 10.3390/s140304948
PubMed Abstract | CrossRef Full Text | Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W., Og Hide, M. (2010). Påvisning av brytningsindeksendringer i individuelle levende celler ved hjelp av overflateplasmon resonansbilder. Biosens. Bioelektron. 26, 674–681. doi: 10.1016 / j.bios.2010.06.065
PubMed Abstract | CrossRef Full Text/Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., Et al. (2015). Etikettfri sporing av enkeltorganelltransport i celler med nanometerpresisjon ved hjelp av en plasmonisk bildeteknikk. Liten 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed Abstract | CrossRef Full Text/Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Kvantifisering av epidermal vekstfaktor reseptor uttrykksnivå og bindende kinetikk på celleoverflater ved overflate plasmon resonans imaging. Anal. Chem. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed Abstrakt | CrossRef Fulltekst/Google Scholar