Etykieta: MEGACE ES – zawiesina octanu megestrolu
Farmakologia kliniczna
istnieje kilka metod analitycznych stosowanych do szacowania stężeń octanu megestrolu w osoczu, w tym chromatografia gazowa-fragmentografia masowa (GC-MF), wysokociśnieniowa chromatografia cieczowa (HPLC) i test radioimmunologiczny (Ria). Metody GC-MF i HPLC są specyficzne dla octanu megestrolu i dają równoważne stężenia. Metoda RIA reaguje z metabolitami octanu megestrolu i dlatego jest niespecyficzna i wskazuje na wyższe stężenia niż metody GC-MF i HPLC. Stężenia w osoczu są zależne nie tylko od zastosowanej metody, ale także od inaktywacji jelit i wątroby leku, na które mogą mieć wpływ takie czynniki, jak ruchliwość przewodu pokarmowego, bakterie jelitowe, podawane antybiotyki, masa ciała, dieta i czynność wątroby.
mechanizm działania
kilku badaczy zgłosiło właściwości zwiększające apetyt octanu megestrolu i jego możliwe zastosowanie w wyniszczeniu. Dokładny mechanizm, dzięki któremu octan megestrolu wywołuje efekty w anoreksji i wyniszczeniu, jest obecnie nieznany.
Właściwości farmakokinetyczne:
stężenia octanu megestrolu w osoczu po podaniu 625 mg (125 mg/mL) zawiesiny doustnej Megace® ES są równoważne w Warunkach karmienia 800 mg (40 mg/mL) zawiesiny doustnej octanu megestrolu (patrz rysunek poniżej).
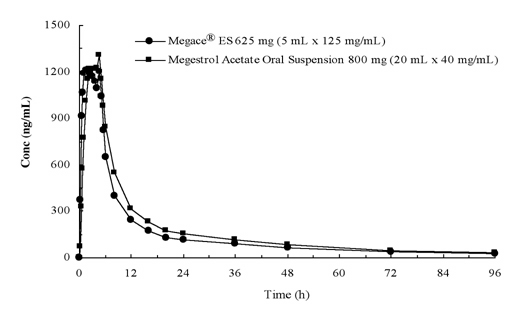
aby scharakteryzować proporcjonalność dawki produktu Megace® ES, przeprowadzono badania farmakokinetyczne w zakresie dawek podawanych na czczo i po posiłku. Farmakokinetyka megestrolu była liniowa w zakresie dawek od 150 mg do 675 mg po podaniu Megace® ES, niezależnie od stanu posiłku. Wartości Cmax i AUC podczas posiłku wysokotłuszczowego były zwiększone odpowiednio o 48% i 36% w porównaniu do wartości Cmax i AUC podczas posiłku na czczo po podaniu produktu Megace® ES w dawce 625 mg (Tabela 1). Jednak posiłek o dużej zawartości tłuszczu znacznie zwiększył AUC i Cmax megestrolu odpowiednio do 2-krotnie i 7-krotnie w porównaniu z posiłkami na czczo po podaniu 800 mg w pierwotnej postaci. Nie było różnicy w bezpieczeństwie po podaniu w stanie karmienia, dlatego Megace ® ES można było przyjmować bez względu na posiłki.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3. |
farmakokinetykę octanu megestrolu w stanie stacjonarnym oceniano u 10 dorosłych, wyniszczonych mężczyzn z zespołem nabytego niedoboru odporności (AIDS) i mimowolną utratą masy ciała większą niż 10% wartości wyjściowej. Pacjenci otrzymywali pojedyncze doustne dawki 800 mg/dobę octanu megestrolu w postaci zawiesiny doustnej przez 21 dni. Dane dotyczące stężenia w osoczu uzyskane w 21. dniu były oceniane przez okres do 48 godzin po podaniu ostatniej dawki.
średnie (±1SD) maksymalne stężenie octanu megestrolu w osoczu (Cmax) wynosiło 753 (±539) ng / mL. Średnia powierzchnia pod krzywą stężenia w czasie (AUC) wynosiła 10476 (±7788) ng x h / mL. Mediana Tmax wynosiła 5 godzin. Siedem z dziesięciu pacjentów przybrało na wadze w ciągu trzech tygodni.
dodatkowo, 24 dorosłych, bezobjawowych, seropozytywnych mężczyzn z HIV otrzymywało raz na dobę 750 mg octanu megestrolu w postaci zawiesiny doustnej. Leczenie prowadzono przez 14 dni. Średnie wartości Cmax i AUC wynosiły odpowiednio 490 (±238) ng/mL i 6779 (±3048) hr x ng/mL. Mediana Tmax wynosiła trzy godziny. Średnia wartość Cmax wynosiła 202 (±101) ng / mL. Średnia % wartości wahań wynosiła 107 (±40).
metabolizm
metabolity octanu megestrolu, które zidentyfikowano w moczu, stanowiły od 5% do 8% podanej dawki. Wydalanie z dróg oddechowych jako oznakowany dwutlenek węgla i magazynowanie tłuszczu może stanowić przynajmniej część radioaktywności, której nie stwierdzono w moczu i Kale.
wydalanie
główną drogą eliminacji leku u ludzi jest mocz. Po podaniu ludziom znakowanego radioizotopem octanu megestrolu w dawkach od 4 do 90 mg, wydalanie z moczem w ciągu 10 dni wahało się od 56,5% do 78,4% (średnio 66,4%), a wydalanie z kałem wahało się od 7,7% do 30,3% (średnio 19,8%). Całkowita odzyskana radioaktywność wahała się między 83,1% a 94,7% (średnio 86,2%).
szczególne populacje
farmakokinetyka octanu megestrolu nie była badana w żadnych szczególnych populacjach.
farmakologia zwierząt i/lub toksykologia
długotrwałe leczenie Megace ® ES (octanem megestrolu) może zwiększać ryzyko infekcji dróg oddechowych. W dwuletnim badaniu toksyczności przewlekłej/rakotwórczości octanu megestrolu przeprowadzonym na szczurach zaobserwowano tendencję do zwiększonej częstości zakażeń układu oddechowego, zmniejszonej liczby limfocytów i zwiększonej liczby neutrofilów.
opis badań klinicznych
octan megestrolu zawiesina doustna w dawce 800 mg/20 mL odpowiada 625 mg/5 mL preparatu Megace ® ES. Skuteczność kliniczną octanu megestrolu w postaci zawiesiny doustnej oceniano w dwóch badaniach klinicznych. Jednym z nich było wieloośrodkowe, randomizowane, podwójnie ślepe, kontrolowane placebo badanie porównujące octan megestrolu (MA) w dawkach 100 mg, 400 mg i 800 mg na dobę w porównaniu z placebo u pacjentów z AIDS z anoreksją/wyniszczeniem i znaczną utratą masy ciała. Spośród 270 pacjentów włączonych do badania, 195 spełniło wszystkie kryteria włączenia/wykluczenia, miało co najmniej dwa dodatkowe pomiary masy ciała po rozpoczęciu badania w okresie 12 tygodni lub jeden pomiar masy ciała po rozpoczęciu badania, ale odpadło z powodu niepowodzenia terapeutycznego. Odsetek pacjentów przy maksymalnym przyroście masy ciała w 12 tygodniach badania był statystycznie znamiennie większy dla grup leczonych MA w dawce 800 mg (64%) i 400 mg (57%) niż dla grupy placebo (24%). Średnie zwiększenie masy ciała od wartości wyjściowej do ostatniej oceny w ciągu 12 tygodni badania w grupie otrzymującej dawkę MA 800 mg o 7.8 funtów, Grupa 400 mg MA o 4.2 funtów, Grupa 100 mg MA o 1.9 funtów i zmniejszyła się w grupie placebo o 1.6 funtów. Średnie zmiany masy ciała po 4, 8 i 12 tygodniach u pacjentów ocenianych pod kątem skuteczności w dwóch badaniach klinicznych przedstawiono graficznie. Zmiany w składzie ciała w ciągu 12 tygodni badania, mierzone za pomocą analizy impedancji bioelektrycznej, wykazały wzrost masy ciała bez wody w grupach leczonych MA (patrz tabela badań klinicznych). Ponadto obrzęk rozwinął się lub pogorszył tylko u 3 pacjentów.
większy odsetek pacjentów leczonych MA w grupie otrzymującej 800 mg (89%), 400 mg (68%) i 100 mg (72%), niż w grupie placebo (50%), wykazał poprawę apetytu w ostatniej ocenie w ciągu 12 tygodni badania. Zaobserwowano statystycznie istotną różnicę pomiędzy grupą otrzymującą MA w dawce 800 mg a grupą placebo w zmianie spożycia kalorii od wartości wyjściowej do czasu maksymalnej zmiany masy ciała. Pacjenci zostali poproszeni o ocenę zmiany masy ciała, apetytu, wyglądu i ogólnego postrzegania dobrego samopoczucia w badaniu 9 pytań. Przy maksymalnej zmianie masy ciała tylko grupa otrzymująca MA w dawce 800 mg dawała odpowiedzi, które były statystycznie istotnie korzystniejsze dla wszystkich pytań w porównaniu z grupą otrzymującą placebo. W badaniu odnotowano odpowiedź na dawkę z pozytywnymi odpowiedziami korelującymi z wyższą dawką dla wszystkich pytań.
drugie badanie było wieloośrodkowym, randomizowanym, podwójnie ślepym, kontrolowanym placebo badaniem porównującym octan megestrolu w dawce 800 mg/dobę z placebo u pacjentów z AIDS z anoreksją/wyniszczeniem i znaczną utratą masy ciała. Spośród 100 pacjentów włączonych do badania, 65 spełniło wszystkie kryteria włączenia/wykluczenia, miało co najmniej dwa dodatkowe pomiary masy ciała po rozpoczęciu badania w okresie 12 tygodni lub miało jeden pomiar masy ciała po rozpoczęciu badania, ale odpadło z powodu niepowodzenia terapeutycznego. U pacjentów w grupie otrzymującej MA w dawce 800 mg obserwowano statystycznie znamiennie większy wzrost średniej maksymalnej zmiany masy ciała niż u pacjentów w grupie placebo. Od początku badania do 12.tygodnia badania średnia masa ciała zwiększyła się o 11,2 funta w grupie leczonej MA i zmniejszyła się o 2,1 funta w grupie placebo. Zmiany w składzie ciała mierzone za pomocą analizy impedancji bioelektrycznej wykazały wzrost masy ciała bez wody w grupie leczonej MA (patrz tabela badań klinicznych). W grupie leczonej MA nie odnotowano obrzęków. Większy odsetek pacjentów leczonych MA (67%) niż pacjentów otrzymujących placebo (38%) wykazał poprawę apetytu w ostatniej ocenie podczas 12 tygodni badania; różnica ta była statystycznie istotna. Nie stwierdzono statystycznie istotnych różnic pomiędzy grupami leczonymi w średniej zmianie kalorycznej lub w dziennym spożyciu kalorii w czasie do maksymalnej zmiany masy ciała. W tym samym badaniu 9 pytań, do którego odwołano się w pierwszym badaniu, oceny pacjentów dotyczące zmiany masy ciała, apetytu, wyglądu i ogólnego postrzegania samopoczucia wykazały wzrost średniej punktacji u pacjentów leczonych MA w porównaniu z grupą placebo.
w obu badaniach pacjenci dobrze tolerowali lek i nie stwierdzono znamiennych statystycznie różnic w wynikach badań laboratoryjnych, nowych zakażeń oportunistycznych, liczby limfocytów, liczby T4, liczby T8 lub testów reaktywności skóry (patrz punkt ADVERSEREACTIONS).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.