Frontiers in Chemistry
- Introducción
- Materiales y métodos
- Materiales
- Configuraciones de imágenes SPR basadas en Prisma
- Preparación del chip del sensor
- Sistema de flujo
- Calibración de sensibilidad
- Resultados y discusión
- Pérdida inicial de Densidad de Masa en la Fijación Celular mediante PFA
- Respuesta a la presión osmótica en la Fijación Celular mediante PFA
- Pérdida sustancial de Densidad de Masa en la Permeabilización Celular por Tritón
- Conclusión
- Las contribuciones de los autores
- Declaración de Conflicto de Intereses
- Agradecimientos
Introducción
La inmunofluorescencia es una técnica poderosa para visualizar la distribución de biomoléculas específicas dentro de muestras biológicas como células y tejidos (Joshi y Yu, 2017). En los ensayos inmunofluorescentes típicos basados en células, las células adherentes se incubaron con anticuerpos fluorescentes para permitir el reconocimiento específico y la unión entre el anticuerpo y la molécula diana en las células. Después de un enjuague completo, la muestra se colocó bajo un microscopio de fluorescencia para obtener una imagen de fluorescencia, de la cual se informó la distribución de las moléculas objetivo mediante las etiquetas fluorescentes. Para facilitar la accesibilidad de los anticuerpos a las moléculas diana e inhibir la actividad celular inherente, las muestras a menudo se fijaron y se permeabilizaron antes de los procedimientos de tinción. Eran particularmente necesarios cuando las moléculas diana estaban localizadas dentro del citoplasma. Entre muchos tipos de reactivos, el paraformaldehído (PFA) y el Tritón X-100 son probablemente los más utilizados para la fijación y la permeabilización, respectivamente. La despolimerización de PFA produjo moléculas de formaldehído para crear enlaces químicos covalentes entre las proteínas de la muestra. El mecanismo de acción dependía de la activación de uno de los residuos de aminoácidos lisina. El PFA también disolvió algunos lípidos en las membranas celulares, lo que dañó ligeramente la integridad de la membrana celular (Fox et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100, como detergente no iónico eficaz, podía disolver los lípidos de las membranas celulares, de modo que la membrana celular se volviera más permeable al anticuerpo fluorescente. El paso de permeabilización eliminó más lípidos de la membrana celular debido a sus grupos de cabezas hidrofílicas sin carga que consisten en mitades de polioxietileno para permitir que moléculas grandes como anticuerpos ingresen dentro de la célula (Jamur y Oliver, 2010; Koley y Bard, 2010). En la Figura 1D se muestra una ilustración esquemática del proceso de fijación celular y permeabilización. A pesar del hecho de que la fijación y la permeabilización se han convertido en procedimientos de rutina en inmunofluorescencia e inmunohistoquímica, se han hecho esfuerzos bastante raros para aclarar cuantitativamente sus influencias en la integridad de la membrana y la densidad de masa celular a nivel de una sola célula.
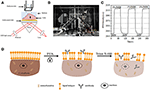
la Figura 1. Configuraciones de imágenes SPR basadas en prisma. A) Ilustración esquemática de la estructura experimental. B) Una fotografía del aparato. C) Curva de calibración de sensibilidad. D) Ilustración esquemática de la fijación celular y la permeabilización.
La resonancia de plasma de superficie (SPR) ha sido una técnica popular y poderosa para determinar la cinética de unión entre un par de moléculas desde su invención en la década de 1980 (Liedberg et al., 1983; Cullen et al., 1987). Esto se atribuye a sus notables ventajas, incluida la medición cinética cuantitativa en tiempo real con altas resoluciones temporales, la compatibilidad con dispositivos expandidos y, lo que es más importante, su característica intrínseca de ausencia de etiquetas (Rothenhäusler y Knoll, 1988; Phillips y Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard et al., 2014; Yanase et al., 2014; Su y Wang, 2018). Las primeras aplicaciones se centraron principalmente en caracterizar y cuantificar las interacciones biomoleculares mediante la inmovilización de moléculas purificadas en sustratos de detección de SPR (portaobjetos de vidrio recubiertos de oro). Tales estudios ex situ no solo requirieron los procedimientos de purificación intensivos en mano de obra, sino que también condujeron a resultados que pueden no reflejar la interacción natural en los seres vivos (Phillips y Cheng, 2007; Homola, 2008). Impulsados tanto por el avance técnico en varios sistemas de imágenes SPR (SPRi) como por la motivación científica en imágenes y análisis de una sola célula, se han empleado técnicas de imágenes SPRi basadas en prisma y objetivos para obtener imágenes de la distribución de masa de células vivas individuales sin la necesidad de etiquetarlas (Wang et al., 2010, 2012a; Yanase et al., 2010; Yang et al., 2015; Zhang et al., 2015). Cada uno tiene sus propios méritos. Este último tiene una resolución espacial más alta y el primero tiene una mejor sensibilidad. Al monitorear las imágenes SPR con lapso de tiempo de células vivas individuales durante varios tipos de estímulos fisiológicos y biológicos, se obtuvo información espacial y dinámica importante sobre las interacciones célula-sustrato (Giebel et al., 1999), migraciones celulares (Smith et al., 2004), respuestas osmóticas (Wang et al., 2012a), cinética de unión al receptor-ligando (Wang et al., 2012b, 2014), vías de señalización (Deng et al., 2016), dinámica de activación de proteínas (Peng et al., 2018), y respuestas a fármacos de células cancerosas vivas (Wang et al., 2018). Por ejemplo, los estudios existentes han demostrado claramente que las técnicas SPRi eran capaces de mapear la densidad de masa, así como la integridad de la membrana a nivel de una sola célula (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). El contraste de imagen del SPRi provino de la distribución subcelular del índice de refracción, que fue determinado aproximadamente por la densidad de masa local. Se encontró que la unión de anticuerpos específicos a la membrana celular que expresaban los antígenos correspondientes, o la estimulación de las células vivas con productos químicos particulares, alteraba la densidad de masa de células individuales de una manera heterogénea y dinámica (Wang et al., 2012a, b). Se encontró que la exposición de células vivas individuales a soluciones hipertónicas induce la contracción de las células, lo que indica la excelente integridad de las membranas celulares (Wang et al., 2012a). Sin embargo, aún no está claro cómo afectarían los tratamientos de fijación y permeabilización a las imágenes de SPR de células individuales.
En el presente trabajo, empleamos un sistema SPRi construido en casa para registrar continuamente las imágenes de SPR con lapso de tiempo de decenas de células vivas individuales cuando las células fueron tratadas sucesivamente con solución de PFA al 4% y solución Triton X-100 al 1%. La densidad de masa de células individuales se determinó por la señal SPRi promediada. La integridad de la membrana se evaluó exponiendo las células a solución hipertónica. Se encontró que, además de la densidad de masa ligeramente reducida por <10%, el tratamiento con AFP destruyó significativamente la integridad celular, como lo indica la pérdida de respuesta osmótica a la exposición de moléculas de azúcar. El tratamiento posterior con Triton X-100, sin embargo, redujo significativamente la densidad de masa en otro 20%, lo que sugiere la destrucción severa de la integridad de la membrana.
Materiales y métodos
Materiales
Solución salina tamponada de fosfato de Dulbecco (PBS, Gibco), Sacarosa (Sinopharm Chemical Reagent Co., Ltd), Triton X-100 (Aladdin), Paraformaldehído (Shanghai Lingfeng Chemical Reagent Co., Ltd). Todos los reactivos se disolvieron en PBS.Cultivo celular
Las células BT-474 se cultivaron a 37 ° C con 5% de CO2 y 70% de humedad relativa en Medio de Águila modificado de Dubelco (DMEM, Invitrogen) con 10% de suero fetal bovino (FBS, Invitrogen), 100 unidades/ml de penicilina y 100 µg/ml de estreptomicina (Invitrogen). Las células se eliminaron cuando estaban en un 70-80% de confluentes mediante tratamiento con solución de tripsina al 0,25% (Gibco).
Configuraciones de imágenes SPR basadas en Prisma
En las Figuras 1A,B se presenta un diagrama esquemático y una foto del sistema SPRi.El aparato SPRi se compone principalmente de tres partes: fuente de luz, componentes ópticos y cámara.
div• * Fuente de luz: Un diodo emisor de luz de 670 nm (L7868-01, Hamamatsu, Japón) y una toma de montaje con control de temperatura (LDM21, Thorlabs, Newton, EE.
• Componentes ópticos (Edmund Optics, EE. 1 vidrio BK7 de Fisherbrand), una lente convergente, un polarizador y una lente sintonizable.
• Cámara: Cámara de dispositivo acoplada a carga (Pike F032B, Tecnología de Visión aliada, Newburyport, EE. UU.).
La luz polarizada p llega a la parte inferior de la diapositiva de vidrio recubierto de oro a través del prisma directamente y la cámara captura el haz reflejado para generar imágenes SPR a una velocidad de 0,828 fotogramas por segundo (fps). Al elegir un aumento de 4X en una lente sintonizable, el campo de visión era de ~2 × 2 mm2.
Preparación del chip del sensor
Cada chip se lavó con etanol al 75% y agua desionizada (DIW), seguido de exposición a rayos UV durante 30 minutos para eliminar la contaminación de la superficie y esterilizarlos antes de cada experimento. Se colocó una cámara de silicio Flexi-Permanente (Greiner Bio-One) en la parte superior del chip de oro para servir como un pozo de cultivo celular. Para lograr la modificación de la superficie antes de la siembra celular, se agregó una solución de colágeno de 100 µg/mL y 150 µL a la cámara y se mantuvo en una incubadora durante 2 h. Luego, el chip se enjuagó con agua desionizada dos veces y DMEM dos veces antes de la siembra celular. Para que las células tuvieran una buena forma, el chip se incubó en el medio de crecimiento durante 36 h. El medio de crecimiento se reemplazó con una solución tampón de PBS durante 10 min para que las células lograran un equilibrio.
Sistema de flujo
Se aplicó un sistema de perfusión de fármacos multicanal impulsado por gravedad para la inyección y el cambio de la solución. La velocidad de flujo es de 300 µL/min y la velocidad de conmutación de la solución alrededor de las celdas puede alcanzar 1-2 s.
Calibración de sensibilidad
Se preparó un chip sensor como se describe en la parte anterior sin modificación de superficie ni siembra de celdas. Primero, el DIW fluyó sobre el chip durante aproximadamente 60 s. Luego, fue reemplazado por una solución de etanol al 1% (v/v) por otros 60 s. Como una de las soluciones de calibración más utilizadas, se sabe que el etanol al 1% aumenta el ángulo SPR del DIW en 60 mDeg. Los resultados experimentales mostraron que la intensidad de la SPR aumentó en 96 U. I. (Figura 1C), lo que corresponde a una sensibilidad de 1,6 ΔI.U. / mDeg.
Resultados y discusión
La membrana celular (también conocida como membrana citoplasmática), que consiste en una bicapa lipídica con proteínas incrustadas, es una membrana semipermeable que encierra el citoplasma de una célula. Los pasos de fijación y permeabilización de células y muestras de tejido, que podrían alterar la permeabilidad de la membrana celular, son procedimientos cruciales que podrían determinar el éxito de los ensayos inmunofluorescentes o inmunohistoquímicos. Además de esto, la calidad de los anticuerpos y el procedimiento de inmunorreacción son otros determinantes clave para este tipo de experimentos. El SPR tiene la característica de que tanto el ángulo resonante como el índice de refracción (RI) cerca de la superficie de detección son altamente sensibles a la densidad de masa de la capa superficial en la interfaz de metal medio. Por lo tanto, las variaciones de densidad de masa de la célula que tienen lugar en o cerca de la película metálica (~200 nm) podrían registrarse sincrónicamente midiendo la intensidad de la luz reflejada. Mediante el empleo de la técnica de resonancia por plasma de superficie, exploramos la distribución dinámica de la densidad de masa celular con altas resoluciones espaciales y temporales y una sensibilidad confiable en los procesos de fijación y permeabilización en este estudio.
Pérdida inicial de Densidad de Masa en la Fijación Celular mediante PFA
El primer paso para preparar muestras biológicas para análisis inmunofluorescentes o inmunohistoquímicos suele ser la fijación. Y los fijadores más comúnmente utilizados para este tipo de ensayos son fijadores de reticulación como el PFA que funciona generando enlaces químicos covalentes entre proteínas en células o tejidos. Por lo tanto, investigamos la influencia del tratamiento con AFP en la densidad de masa celular. Las células vivas BT-474 se cultivaron en cubreobjetos recubiertos con película de oro con un grosor de 50 nm. En la Figura 2A se proporciona una imagen SPR representativa que contiene células individuales. Las señales SPR de cada célula se pueden obtener eligiendo una región de interés en la imagen SPR que coincida con la morfología de la célula investigada. En un experimento típico, cuando la solución fluyó sobre las células, se obtuvieron sensores SPR de las células analizando cada célula como se muestra en la Figura 2B (curva negra). En los 242 s anteriores, el tampón de PBS sin PFA fluía sobre las células y la línea de base estaba determinada por la estabilidad del sistema (fuente de luz y estabilidad mecánica) y las señales de micromoción inherentes generadas por las células vivas. La solución de PFA se introdujo en el segundo 242, lo que aumentó inmediatamente la señal SPR debido al índice de refracción relativamente grande de la solución de PFA al 4% (efecto a granel). La solución de PFA funcionó durante otros 17 minutos para lograr una fijación suficiente. En el segundo 1237, la solución PFA se cambió de nuevo a la solución PBS pura. Además del efecto de masa reducida, se encontró una disminución en la intensidad de la SPR de células individuales al comparar las señales antes (0-242) y después (1237-1545) de los tratamientos con AFP y el porcentaje de pérdida de masa se obtuvo dividiendo el valor de disminución con el valor inicial. Los sensongramas SPR del fondo (una región adyacente sin adhesión celular, curva azul) y una sola célula tratada con PBS durante 1,500 s (curva gris) también se muestran en la Figura 2B. El análisis estadístico de 30 células revela una pérdida de densidad de masa promedio de 10 ± 5%, como se muestra en la Figura 2C. También se encontró que, después del tratamiento con AFP, el nivel de fluctuación basal en la señal SPR se redujo significativamente a la mitad o incluso a dos tercios, lo que sugiere la pérdida de micromociones y fijación de las células tratadas, como se muestra en la Figura 2D. Dichas señales de micromoción fueron generadas por un grupo de actividades celulares dinámicas de diferentes componentes celulares, incluidos el esqueleto, las membranas y los orgánulos. La fijación puso fin a tales actividades biológicas y, por lo tanto, eliminó las señales de micromoción, acompañando con una fluctuación de intensidad significativamente reducida en los sensogramas SPR de células individuales.
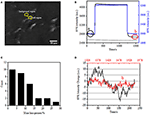
la Figura 2. Proceso de fijación celular. A) Imagen de ramificación de células BT-474. B) Señales SPR de célula única (curva negra) y fondo (curva azul) sometidas a un proceso de conmutación de solución: tampón de PBS al 4% de tampón de PFA a PBS. Señal SPR de célula única tratada con PBS durante 1.500 s (curva gris). C) Distribución de pérdida de masa de 30 células individuales. D) Nivel sonoro de la célula antes (a) y después (b) del tratamiento con AFP.
Respuesta a la presión osmótica en la Fijación Celular mediante PFA
La estructura integrada de la membrana celular, una membrana semipermeable, regula la homeostasis de una célula para alcanzar el equilibrio en la presión osmótica fisiológica. También se encontró que el tratamiento con AFP tiene la capacidad de destruir la integridad de la membrana, como se muestra en la Figura 3. Cuando el tampón alrededor de la célula diana se transformó en una solución de sacarosa de 25 mm en <1 s a través de un sistema de perfusión de fármacos, se creó un entorno de cultivo celular hipertónico. Para las células vivas, la exposición a la solución hipertónica desencadenó una serie de respuestas fisiológicas para equilibrar la presión osmótica intracelular y extracelular, que se ha investigado en detalle en nuestro trabajo anterior (Wang et al., 2012a). En este estudio, en la Figura 3A se proporciona un sensor de SPR típico de células fisiológicas únicas BT-474. Tras la exposición a solución de sacarosa hipertónica, las células tratadas primero se sometieron a un encogimiento por presión, lo que llevó a un aumento gradual de la intensidad de SPR hasta que se alcanzó una meseta. Sugirió el aumento de la densidad de masa como resultado del encogimiento celular y la acumulación de componentes subcelulares hacia el fondo del cubreobjetos de cultivo de oro. El aumento gradual de la intensidad de la SPR por estimulación hipertónica es una especie de regulación fisiológica de la presión osmótica celular, lo que indica la integridad fisiológica de la membrana celular. Cuando se destruyó la integridad de la membrana, se encontró que la introducción de solución de sacarosa hipertónica aumentaba inmediatamente la intensidad de la SPR en un tiempo mucho más corto, como se muestra en la Figura 3B. Esto se debe a que las moléculas de azúcar penetraron libremente en las células sin resistencia de la membrana semipermeable y aumentaron el índice de refracción local de inmediato (efecto a granel). Está claro que, mientras el lento aumento de la intensidad de la SPR reflejaba la regulación osmótica fisiológica (Figura 3A), el salto rápido demostró que la membrana celular había sido dañada para permitir la libre entrada de pequeñas moléculas de azúcar (Figura 3B).

la Figura 3. Respuestas de presión osmótica de las células. A) Respuesta de una célula viva a 25 mm de sacarosa. B) Respuesta de la misma célula fija (10 min) a 25 mm de sacarosa.
Pérdida sustancial de Densidad de Masa en la Permeabilización Celular por Tritón
En la etapa de fijación anterior, la densidad inicial de masa celular disminuyó apenas en ~10% (Figura 2C). Es razonable especular que la fijación de PFA solo destruyó ligeramente la integridad de la membrana y aumentó la permeabilidad de moléculas pequeñas. La mayoría de los componentes intracelulares deben estar todavía albergados dentro de la membrana citoplasmática. Posteriormente estudiamos la influencia de un detergente de permeabilización típico, Triton X-100 al 1%, en células que se han fijado con PFA durante 17 min previamente. En la Figura 4A se muestra un sensorgrama de SPR representativo de células individuales durante la exposición a Tritón X-100 al 1%. La introducción de Tritón X-100 aumentó la intensidad de SPR seguido de una disminución gradual. El primer aumento es consecuencia del aumento del índice de refracción de la solución a granel, y la disminución seguida indicó la pérdida gradual de la densidad de masa debido a la permeabilización celular. La densidad de masa reducida fue más abundante al comparar el cambio de intensidad de SPR antes (0-300 s) y después de la introducción de detergente (1,300–1,800 s). El análisis en 30 células individuales demostró que el tratamiento Triton X-100 creó una disminución sustancial de la densidad de masa en otro 20 ± 5% después de la fijación de PFA, como se muestra en la Figura 4D y en la Tabla 1. Está claro que el detergente Triton X-100 eliminó muchos más lípidos de la membrana celular y destruyó severamente la integridad de la membrana en esta etapa de permeabilización. Esto dio lugar a la liberación de más componentes intracelulares, especialmente macromoléculas, de las células. Y también, esto permite que moléculas grandes como anticuerpos entren dentro de la célula en la siguiente etapa de inmunorreacción. Aunque la intensidad de SPR de la lixiviación de moléculas pequeñas se detectó después de la fijación de PFA, la permeabilización mediante el uso de detergente Triton X-100 claramente solubilizó los lípidos y hizo que las células fueran mucho más permeables a los movimientos de macromoléculas dentro y fuera del cuerpo celular.
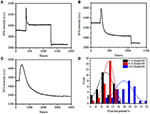
la Figura 4. Curvas de pérdida de masa de células tratadas con diferentes soluciones de concentración (A) 1,0%, (B) 0,5%, (C) 0,1%. D) Distribución de pérdida de masa de 30 células individuales en diferentes condiciones.

la Tabla 1. Resumen de las variaciones en la pérdida de densidad de masa de células estadísticas en diferentes condiciones.
Se encontró que la pérdida de densidad de masa es un proceso bastante rápido, que ocurrió en pocos minutos en la etapa de permeabilización (Figura 4A). La disminución de la densidad de masa siguió aproximadamente a una desintegración monótona dentro de un período de tiempo de 126 s. Los sensores típicos de células individuales con menos de 0,5 y 0,1% de Tritón X-100 se muestran en las Figuras 4B,C, respectivamente. El proceso de permeabilización se hizo mucho más lento al reducir la concentración de detergente. Los tres tipos de células tratadas tardaron 126, 510, 2600 s en terminar la pérdida de masa.
Conclusión
En resumen, la redistribución dinámica de la densidad de masa celular en los procesos de fijación y permeabilización se ha explorado con sensibilidad mediante el uso de una configuración de RAM basada en prisma con altas resoluciones espaciales y temporales. El PFA fijador inicialmente podría aumentar la permeabilidad de la membrana citoplasmática hasta cierto punto debido a su capacidad de fijar proteínas celulares tanto en proteínas de membrana como intracelulares. Fue apoyado por (1) la disminución de la densidad de masa en ~10% después de un tratamiento de fijación de 17 minutos en solución de PFA al 4%, y (2) la respuesta celular eliminada a la solución hipertónica, que demostró la destrucción de la integridad celular a moléculas pequeñas como los azúcares. El detergente Triton X-100 es superior al fijador PFA en lípidos solubilizantes y, por lo tanto, aumenta la permeabilidad de la membrana celular, acompañando con la pérdida más sustancial de la densidad de masa debido a la liberación no solo de moléculas pequeñas, sino también de moléculas grandes y posiblemente algunos orgánulos como vesículas. Además, la tasa de pérdida de masa se correlaciona positivamente con la concentración de Tritón X-100. Estos resultados proporcionaron una comprensión cuantitativa y dinámica de la influencia de la fijación y la permeabilización en la densidad de masa celular y la integridad de la membrana, con implicaciones para optimizar las condiciones de los experimentos biológicos unicelulares, como los ensayos inmunofluorescentes e inmunohistoquímicos.
Las contribuciones de los autores
RC, Y-WS y WW diseñaron los experimentos. RC, FZ, ML y XW realizaron los experimentos. RC, Y-WS y WW escribieron el artículo. RC, FZ, Y-WS y WW discutieron los resultados y analizaron los datos.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El editor responsable declaró una afiliación compartida, aunque no otra colaboración, con los autores WW, RC, ML y XW en el momento de la revisión.
Agradecimientos
Agradecemos el apoyo financiero de la Fundación Nacional de Ciencias Naturales de China (Subvención No. 21522503).Abadian, P. N., Kelley, C. P., y Goluch, E. D. (2014). Análisis y detección celular mediante técnicas de resonancia de plasmones de superficie. Anal. Chem. 86, 2799–2812. doi: 10.1021 / ac500135s
Resumen PubMed / Texto completo cruzado / Google Scholar
Cullen, D. C., Brown, R. G. W., and Lowe, C. R. (1987). Detección de la formación de complejos inmunológicos a través de resonancia de plasmón superficial en rejillas de difracción recubiertas de oro. Biosensores 3, 211-225. doi: 10.1016 / 0265-928X (87)85002-2
Resumen de PubMed | Texto completo cruzado/Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., and Wang, P. (2016). Un dispositivo microfluídico de dos compartimentos para la detección de células vivas a largo plazo basado en resonancia de plasma de superficie. Biomicrofluidics 10: 044109. doi: 10.1063 / 1.4960487
Resumen de PubMed / Texto completo cruzado / Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J., and Roller, P. P. (1985). Fijación de formaldehído. J. Histochem. Citoquem. 33, 845–853. doi: 10.1177 / 33.8.3894502
Resumen de PubMed | Texto completo cruzado | Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Obtención de imágenes de contactos de células/sustrato de células vivas con microscopía de resonancia de plasmón de superficie. Biophys. J. 76, 509-516. doi: 10.1016 / S0006-3495 (99)77219-X
Resumen PubMed | Texto completo Cruzado | Google Scholar
Homola, J. (2008). Sensores de resonancia de plasmón de superficie para la detección de especies químicas y biológicas. Chem. Apo. 108, 462-493. doi: 10.1021 / cr068107d
Resumen PubMed / Texto completo cruzado / Google Scholar
Jamur, M. C., and Oliver, C. (2010). «Permeabilization of cell membranes», en Immunocytochemical Methods and Protocols, eds C. Oliver y M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007 / 978-1-59745-324-0_9
Texto completo cruzado | Google Scholar
Joshi, S., and Yu, D. (2017). «Chapter 8-Immunofluorescence,» in Basic Science Methods for Clinical Researchers, eds M. Jalali, F. Y. L. Saldanha, and M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016/B978-0-12-803077-6.00008-4
CrossRef Texto Completo | Google Scholar
Kiernan, J. A. (2018). Formaldehído, formalina, paraformaldehído y glutaraldehído: qué son y qué hacen. Microcréditos. Hoy 8, 8-13. doi: 10.1017 / S1551929500057060
Texto completo de CrossRef / Google Scholar
Koley, D., and Bard, A. J. (2010). Triton X – 100 efectos de concentración sobre la permeabilidad de la membrana de una sola célula HeLa mediante microscopía electroquímica de barrido (SECM). Proc. Natl. Acad. Sci. U. S. A. 107, 16783-16787. doi: 10.1073 / pnas.1011614107
Resumen de PubMed / Texto completo cruzado / Google Scholar
Liedberg, B., Nylander, C., and Lunström, I. (1983). Resonancia de plasma de superficie para detección de gases y biosensor. Los Senadores Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Full Text / Google Scholar
Méjard, R., Griesser, H. J., and Thierry, B. (2014). Biosensor óptico para estudios celulares sin etiquetas. Trac Trends Anal. Chem. 53, 178–186. doi: 10.1016 / j.trac.2013.08.012
Texto completo cruzado | Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y., and Li, J. (2018). Imágenes sin etiqueta de la respuesta inducida por los receptores del factor de crecimiento epidérmico en células vivas individuales. Analista 143, 5264-5270. doi: 10.1039 / C8AN01534A
Resumen PubMed / Texto completo cruzado / Google Académico
Phillips, K. S., and Cheng, Q. (2007). Avances recientes en técnicas basadas en resonancia de plasmones de superficie para bioanálisis. Anal. Bioanal. Chem. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
Resumen de PubMed | Texto completo cruzado/Google Scholar
Rothenhäusler, B., and Knoll, W. (1988). Microscopía de plasma de superficie. Nature 332, 615-617. doi: 10.1038/332615a0
CrossRef Texto Completo | Google Scholar
Smith, J. T., Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B., and Reichert, W. M. (2004). Medición de la migración celular en gradientes de fibronectina unidos a la superficie. Langmuir 20, 8279-8286. doi: 10.1021 / la0489763
Resumen de PubMed / Texto completo cruzado / Google Scholar
Su, Y. W., and Wang, W. (2018). Detección de resonancia de plasmón de superficie: desde biomoléculas purificadas hasta células intactas. Anal. Bioanal. Chem. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
Resumen de PubMed / Texto completo Cruzado/Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., and Ranganathan, K. (2012). Fundamentos químicos y físicos de la fijación rutinaria de formaldehído. J. Maxilofac Oral. Pathol. 16, 400–405. doi: 10.4103/0973-029X.102496
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Obtención de imágenes sin etiquetas, detección y medición de masa de virus individuales mediante resonancia de plasmón de superficie. Proc. Natl. Acad. Sci. U. S. A. 107, 16028-16032. doi: 10.1073 / pnas.1005264107
Resumen de PubMed | Texto completo cruzado/Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J., and Tao, N. (2012a). Mapeo de las interacciones entre sustrato unicelular mediante microscopía de resonancia de plasma de superficie. Langmuir 28, 13373-13379. doi: 10.1021 / la301712h
Resumen de PubMed / Texto completo cruzado/Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). Medición y mapeo sin etiquetas de la cinética de unión de proteínas de membrana en células vivas individuales. NAT. Chem. 4, 846–853. doi: 10.1038 / nchem.1434
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). Cinética de unión a receptores de fármacos in situ en células individuales: un estudio cuantitativo sin etiquetas de resistencia a fármacos antitumorales. Sci. República 4:6609. doi: 10.1038/srep06609
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Detección ultrasensible y ultrarrápida de las respuestas de células cancerosas vivas sin etiquetar al paclitaxel con un biosensor a base de grafeno. Los Senadores Actuat. B Chem. 263, 417–425. doi: 10.1016 / j.snb.2018.02.095
CrossRef Texto Completo | Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Resonancia de plasma de superficie para el diagnóstico clínico basado en células. Sensores 14, 4948-4959. doi: 10.3390/s140304948
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W., and Hide, M. (2010). Detección de cambios en el índice de refracción en células vivas individuales mediante imágenes de resonancia de plasmón de superficie. Biosens. Bioelectrón. 26, 674–681. doi: 10.1016 / j. bios.2010.06.065
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Seguimiento sin etiquetas del transporte de orgánulos individuales en células con precisión nanométrica utilizando una técnica de imagen plasmónica. Small 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Cuantificación del nivel de expresión del receptor del factor de crecimiento epidérmico y cinética de unión en superficies celulares mediante imágenes de resonancia de plasmón de superficie. Anal. Chem. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
Resumen de PubMed / Texto completo de CrossRef / Google Scholar