Apprêt de microscopie d’Expressions moléculaires: Didacticiel interactif de Fluorescence – Photoblanchiment
- Didacticiels interactifs de microscopie à fluorescence
- Photoblanchiment
- Questions ou commentaires? Envoyez-nous un email.
- © 1998-2021 par Michael W. Davidson et l’Université d’État de Floride. Tous Droits réservés. Aucune image, graphique, script ou applets ne peut être reproduit ou utilisé de quelque manière que ce soit sans l’autorisation des détenteurs des droits d’auteur. L’utilisation de ce site Web signifie que vous acceptez toutes les Conditions légales énoncées par les propriétaires.
- Ce site Web est maintenu par notre équipe de programmation WebGraphics&en collaboration avec la Microscopie Optique du Laboratoire National de Champ Magnétique Élevé.
- Dernière modification : Lundi 12 sept. 2016 à 13h58
- Nombre d’accès Depuis le 10 juin 2003: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
Didacticiels interactifs de microscopie à fluorescence
Photoblanchiment
Le phénomène de photoblanchiment (aussi communément appelé décoloration) se produit lorsqu’un fluorophore perd de façon permanente la lumière capacité de fluorescence due à des dommages chimiques induits par les photons et à une modification covalente. Lors de la transition d’un état singulet excité à l’état triplet excité, les fluorophores peuvent interagir avec une autre molécule pour produire des modifications covalentes irréversibles. L’état triplet a une durée de vie relativement longue par rapport à l’état singulet, ce qui permet aux molécules excitées de subir des réactions chimiques avec des composants dans l’environnement pendant un délai beaucoup plus long. Le nombre moyen de cycles d’excitation et d’émission qui se produisent pour un fluorophore particulier avant le photoblanchiment dépend de la structure moléculaire et de l’environnement local. Certains fluorophores blanchissent rapidement après n’avoir émis que quelques photons, tandis que d’autres plus robustes peuvent subir des milliers ou des millions de cycles avant de blanchir. Ce didacticiel interactif explore les variations des taux de photoblanchiment dans des échantillons de fluorescence marqués à une, deux et plusieurs marques.
Le tutoriel s’initialise avec une paire d’images de fluorescence identiques apparaissant dans les fenêtres d’Image Écrue et d’Image Photoblanchée. Pour utiliser le tutoriel, cliquez sur le bouton de l’obturateur pour ouvrir l’obturateur virtuel et permettre à l’image Photoblanchée de s’estomper ou de se photoblancher à une vitesse considérablement exagérée sur une période de temps fixe. La décoloration peut être arrêtée à tout moment en cliquant sur le bouton Pause (qui devient un bouton de démarrage), puis reprise en cliquant sur le bouton de démarrage. Dans les échantillons à double et triple marquage, les différents taux de blanchiment des fluorophores individuels peuvent être visualisés individuellement à l’aide des cases à cocher Canaux de couleur (le paramètre par défaut est tous les canaux activés). Par exemple, en cliquant sur la case à cocher rouge pour un spécimen avec un triple étiquetage, seul le canal de couleur rouge apparaîtra. Deux ou les trois canaux de couleur peuvent être mélangés ensemble dans des échantillons étiquetés en plusieurs à l’aide de la case à cocher Ajouter. Un nouveau spécimen peut être sélectionné à l’aide du menu déroulant Choisir un spécimen. Les noms des échantillons comprennent les informations d’étiquetage des fluorophores suivantes: FITC, isothiocyanate de fluorescéine; Fluorophore triple, un fluorophore rouge, vert et bleu; Dual, deux fluorophores; DAPI, 4 ‘, 6-diamidino-2-phénylindole; MitoTracker, une sonde mitochondriale; Alexa 488, un fluorophore vert; et Auto, autofluorescence. Le tutoriel est conçu pour modifier de manière aléatoire les taux de photoblanchiment pour les fluorophores individuels lors du rechargement, de sorte que cliquer sur le bouton de l’obturateur à plusieurs reprises montrera comment l’image apparaît lorsque le taux de blanchiment de fluorescence change pour chacun des signaux de couleur.
Parce que le photoblanchiment, un phénomène très mal compris, entraîne une perte dramatique d’intensité d’émission de fluorescence dans la plupart des échantillons, le contrôle de l’artefact est essentiel pour capturer avec succès des images satisfaisantes. À titre d’exemple pour un fluorochrome typique, le rendement quantique pour le photoblanchiment de la fluorescéine à une intensité d’éclairage moyenne à élevée dicte qu’une molécule moyenne émettra entre 30 et 40 mille photons au cours de sa durée de vie utile (avant de devenir définitivement désactivée). De plus, le nombre de cycles d’excitation et d’émission est constant pour un fluorophore donné quelle que soit la façon dont l’énergie d’excitation est délivrée, soit par impulsions discrètes, soit par illumination continue. Par conséquent, la réduction du niveau de lumière d’excitation en utilisant des filtres à densité neutre n’empêche pas le photoblanchiment, elle réduit simplement la vitesse.
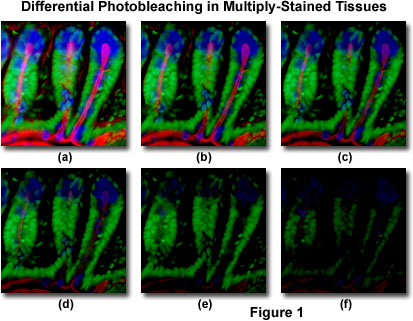
La figure 1 présente un exemple typique de photoblanchiment (décoloration) observé dans une série d’images numériques capturées à différents moments pour une section mince de cryostat à coloration multiple (16 micromètres) d’intestin de souris. Les noyaux ont été colorés avec du vert Sytox (fluorescence verte), tandis que le mucus des cellules caliciformes et l’actine filamenteuse dans la bordure de la brosse ont été colorés avec de l’agglutinine de germe de blé Alexa Fluor 350 (fluorescence bleue) et de la phalloïdine Alexa Fluor 568 (fluorescence rouge), respectivement. Les points temporels ont été pris par intervalles de deux minutes à l’aide d’une combinaison de filtres de fluorescence avec des largeurs de bande accordées pour exciter les trois fluorophores simultanément tout en enregistrant les signaux d’émission combinés. Notez que les trois fluorophores ont une intensité relativement élevée dans la figure 1 (a), mais les intensités Alexa Fluor 350 et 568 (bleu et rouge) commencent à baisser rapidement à deux minutes et disparaissent presque complètement à six minutes. Les noyaux colorés en vert sont plus résistants au photoblanchiment, mais leur intensité diminue également régulièrement au cours de la séquence chronométrée (10 minutes). Une grande variété de réactifs antifades synthétiques réduiront considérablement le taux de photoblanchiment.
Une classe importante d’événements de photoblanchiment est photodynamique, ce qui signifie qu’ils impliquent l’interaction du fluorophore avec une combinaison de lumière et d’oxygène. Les réactions entre les fluorophores et l’oxygène moléculaire détruisent en permanence la fluorescence et produisent une espèce d’oxygène singulet radicalaire qui peut modifier chimiquement d’autres molécules dans les cellules vivantes. La quantité de photoblanchiment due aux événements photodynamiques est fonction de la concentration en oxygène moléculaire et de la distance proximale entre le fluorophore, les molécules d’oxygène et d’autres composants cellulaires. Le photoblanchiment peut être réduit en limitant le temps d’exposition des fluorophores à l’éclairage ou en abaissant l’énergie d’excitation. Cependant, ces techniques réduisent également le signal de fluorescence mesurable. Dans de nombreux cas, des solutions de fluorophores ou de suspensions cellulaires peuvent être désoxygénées, mais cela n’est pas réalisable pour les cellules et les tissus vivants. La meilleure protection contre le photoblanchiment est peut-être de limiter l’exposition du fluorochrome à un éclairage intense (en utilisant des filtres à densité neutre) couplé à l’utilisation judicieuse de réactifs antifade disponibles dans le commerce pouvant être ajoutés à la solution de montage ou au milieu de culture cellulaire.
Dans certaines circonstances, l’effet de photoblanchiment peut également être utilisé pour obtenir des informations spécifiques qui ne seraient pas disponibles autrement. Par exemple, dans la récupération de fluorescence après des expériences de photoblanchiment (FRAP), les fluorophores dans une région cible sont blanchis intentionnellement avec des niveaux excessifs d’irradiation. Lorsque de nouvelles molécules de fluorophore diffusent dans la région blanchie de l’échantillon (récupération), l’intensité d’émission de fluorescence est surveillée pour déterminer les vitesses de diffusion latérale du fluorophore cible. De cette manière, la mobilité translationnelle des molécules marquées par fluorescence peut être déterminée dans une très petite région (2 à 5 micromètres) d’une seule cellule ou section de tissu vivant.
Auteurs contributeurs
Brian Herman – Département de Biologie cellulaire et Structurale, Centre des sciences de la Santé de l’Université du Texas, 7703 Floyd Curl Drive, San Antonio, Texas 78229.
Matthew J. Parry-Hill, Ian D. Johnson et Michael W. Davidson – National High Magnetic Field Laboratory, 1800 East Paul Dirac Dr., Université d’État de Floride, Tallahassee, Floride, 32310.
RETOUR À L’INTRODUCTION DE LA FLUORESCENCE
RETOUR À LA MICROSCOPIE À FLUORESCENCE
Questions ou commentaires? Envoyez-nous un email.
© 1998-2021 par Michael W. Davidson et l’Université d’État de Floride. Tous Droits réservés. Aucune image, graphique, script ou applets ne peut être reproduit ou utilisé de quelque manière que ce soit sans l’autorisation des détenteurs des droits d’auteur. L’utilisation de ce site Web signifie que vous acceptez toutes les Conditions légales énoncées par les propriétaires.
Ce site Web est maintenu par notre équipe de programmation Web
Graphics&en collaboration avec la Microscopie Optique du Laboratoire National de Champ Magnétique Élevé.
Dernière modification : Lundi 12 sept. 2016 à 13h58
Nombre d’accès Depuis le 10 juin 2003: 116208
![]()
![]()
![]()
![]()