Frontiers in Chemistry
- Introduction
- Matériaux et méthodes
- Matériaux
- Culture cellulaire
- Configurations d’imagerie SPR à base de prisme
- Préparation de la puce du capteur
- Système d’écoulement
- Étalonnage de la sensibilité
- Résultats et discussion
- Perte de Densité de Masse initiale dans la Fixation cellulaire par PFA
- Réponse à la pression osmotique dans la fixation cellulaire par PFA
- Perte importante de densité de masse dans la perméabilisation cellulaire par Triton
- Conclusion
- Contributions des auteurs
- Déclaration sur les conflits d’intérêts
- Remerciements
Introduction
L’immunofluorescence est une technique puissante pour visualiser la distribution de biomolécules spécifiques au sein d’échantillons biologiques tels que les cellules et les tissus (Joshi et Yu, 2017). Dans des essais immunofluorescents typiques à base de cellules, des cellules adhérentes ont été incubées avec un anticorps fluorescent pour permettre une reconnaissance et une liaison spécifiques entre l’anticorps et la molécule cible dans les cellules. Après un rinçage complet, l’échantillon a été placé sous microscope à fluorescence pour obtenir une image de fluorescence, à partir de laquelle la distribution des molécules cibles a été rapportée par les balises fluorescentes. Afin de faciliter l’accessibilité des anticorps aux molécules cibles et d’inhiber l’activité cellulaire inhérente, les échantillons étaient souvent fixés et perméabilisés avant les procédures de coloration. Ils étaient particulièrement nécessaires lorsque les molécules cibles étaient situées dans le cytoplasme. Parmi de nombreux types de réactifs, le paraformaldéhyde (PFA) et le Triton X-100 sont probablement les plus utilisés pour la fixation et la perméabilisation, respectivement. La dépolymérisation du PFA a produit des molécules de formaldéhyde pour créer des liaisons chimiques covalentes entre les protéines de l’échantillon. Le mécanisme de l’action reposait sur l’activation de l’un des résidus d’acides aminés lysine. La PFA a également dissous certains lipides dans les membranes cellulaires, ce qui a légèrement endommagé l’intégrité de la membrane cellulaire (Fox et al., 1985; Thavarajah et coll., 2012; Kiernan, 2018). Le Triton X-100, en tant que détergent non ionique efficace, pourrait dissoudre les lipides des membranes cellulaires, de sorte que la membrane cellulaire devienne plus perméable à l’anticorps fluorescent. L’étape de perméabilisation a éliminé plus de lipides membranaires cellulaires en raison de ses groupes de tête hydrophiles non chargés constitués de fragments de polyoxyéthylène pour permettre à de grosses molécules comme des anticorps de pénétrer à l’intérieur de la cellule (Jamur et Oliver, 2010; Koley et Bard, 2010). Une illustration schématique du processus de fixation et de perméabilisation des cellules est illustrée à la figure 1D. Malgré le fait que la fixation et la perméabilisation soient devenues des procédures de routine en immunofluorescence et en immunohistochimie, des efforts assez rares ont été faits pour clarifier quantitativement leurs influences sur l’intégrité membranaire et la densité de masse cellulaire au niveau d’une seule cellule.
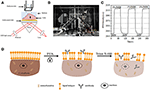
Figure 1. Configurations d’imagerie SPR basées sur des prismes. A) Illustration schématique du dispositif expérimental. B) Une photographie de l’appareil. C) Courbe d’étalonnage de la sensibilité. D) Illustration schématique de la fixation et de la perméabilisation des cellules.
La résonance plasmon de surface (SPR) est une technique populaire et puissante pour déterminer la cinétique de liaison entre une paire de molécules depuis son invention dans les années 1980 (Liedberg et al., 1983; Cullen et coll., 1987). Cela est attribué à ses avantages remarquables, notamment la mesure cinétique quantitative en temps réel avec des résolutions temporelles élevées, la compatibilité avec des appareils étendus et, surtout, sa caractéristique intrinsèque de ne pas être étiqueté (Rothenhäusler et Knoll, 1988; Phillips et Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard et coll., 2014; Yanase et coll., 2014; Su et Wang, 2018). Les premières applications étaient principalement axées sur la caractérisation et la quantification des interactions biomoléculaires en immobilisant des molécules purifiées sur des substrats de détection SPR (lames de verre revêtues d’or). De telles études ex situ ont non seulement nécessité des procédures de purification à forte intensité de main-d’œuvre, mais ont également conduit à des résultats qui peuvent ne pas refléter l’interaction naturelle chez les êtres vivants (Phillips et Cheng, 2007; Homola, 2008). Motivés à la fois par les progrès techniques dans divers systèmes d’imagerie SPR (SPRi) et par la motivation scientifique dans l’imagerie et l’analyse unicellulaires, des techniques SPRi à prisme et à base d’objectifs ont été utilisées pour imager la distribution de masse de cellules vivantes uniques sans avoir besoin de marquage (Wang et al., 2010, 2012a; Yanase et coll., 2010; Yang et coll., 2015; Zhang et coll., 2015). Chacun a ses propres mérites. Ce dernier a une résolution spatiale plus élevée et le premier a une meilleure sensibilité. En surveillant les images SPR temporelles de cellules vivantes uniques lors de différents types de stimulations physiologiques et biologiques, des informations spatiales et dynamiques importantes concernant les interactions cellule-substrat (Giebel et al., 1999), les migrations cellulaires (Smith et al., 2004), les réponses osmotiques (Wang et al., 2012a), cinétique de liaison des récepteurs ligands (Wang et al., 2012b, 2014), voies de signalisation (Deng et al., 2016), dynamique d’activation des protéines (Peng et al., 2018), et les réponses des médicaments à base de cellules cancéreuses vivantes (Wang et al., 2018) ont été obtenus. Par exemple, les études existantes ont clairement démontré que les techniques SPRi étaient capables de cartographier la densité de masse ainsi que l’intégrité de la membrane au niveau d’une seule cellule (Yanase et al., 2010; Wang et coll., 2012b; Yang et coll., 2015). Le contraste de l’image de SPRi provenait de la distribution subcellulaire de l’indice de réfraction, qui était approximativement déterminée par la densité de masse locale. La liaison d’anticorps spécifiques sur la membrane cellulaire exprimant les antigènes correspondants, ou la stimulation des cellules vivantes avec des produits chimiques particuliers, modifient la densité de masse des cellules individuelles de manière hétérogène et dynamique (Wang et al., 2012a, b). Il a été constaté que l’exposition de cellules vivantes uniques à des solutions hypertoniques induisait la contraction des cellules, ce qui indique l’excellente intégrité des membranes cellulaires (Wang et al., 2012a). Cependant, la façon dont les traitements de fixation et de perméabilisation affecteraient les images SPR des cellules individuelles reste incertaine.
Dans le présent travail, nous avons utilisé un système SPRi construit à la maison pour enregistrer en continu les images SPR temporelles de dizaines de cellules vivantes uniques lorsque les cellules ont été traitées successivement par une solution de PFA à 4% et une solution de Triton X-100 à 1%. La densité de masse des cellules individuelles a été déterminée par le signal SPRi moyen. L’intégrité de la membrane a été évaluée en exposant les cellules à une solution hypertonique. Il a été constaté qu’en plus de la densité massique légèrement réduite de < 10%, le traitement par PFA a considérablement détruit l’intégrité cellulaire, comme l’indique la perte de réponse osmotique lors de l’exposition des molécules de sucre. Un traitement ultérieur par Triton X-100, cependant, a considérablement réduit la densité massique de 20% supplémentaires, suggérant la destruction sévère de l’intégrité de la membrane.
Matériaux et méthodes
Matériaux
Solution saline tamponnée au phosphate de Dulbecco (PBS, Gibco), Saccharose (Réactif chimique Sinopharm Co., Ltd), Triton X-100 (Aladdin), Paraformaldéhyde (Shanghai Lingfeng Chemical Reagent Co., Ltd). Tous les réactifs ont été dissous dans du PBS.
Culture cellulaire
Les cellules BT-474 ont été cultivées à 37 °C avec 5% de CO2 et 70% d’humidité relative dans le Milieu Eagle Modifié de Dubelco (DMEM, Invitrogen) avec 10% de sérum fœtal bovin (FBS, Invitrogen), 100 unités/mL de pénicilline et 100 µg/mL de streptomycine (Invitrogen). Les cellules ont été passées lorsqu’elles étaient confluentes à 70-80% par traitement avec une solution de trypsine à 0,25% (Gibco).
Configurations d’imagerie SPR à base de prisme
Un schéma et une photo du système SPRi sont présentés dans les figures 1A, B. L’appareil SPRi est principalement composé de trois parties: source de lumière, composants optiques et caméra.
• Source lumineuse: Une diode électroluminescente de 670 nm (L7868-01, Hamamatsu, Japon) et une prise de montage à température contrôlée (LDM21, Thorlabs, Newton, États-Unis).
• Composants optiques (Edmund Optics, USA): Un prisme SF-11 triangulaire avec une puce de capteur allumée (No. 1 verre BK7 de Fisherbrand), une lentille convergente, un polariseur et une lentille accordable.
• Caméra: Caméra à dispositif à couplage de charge (Pike F032B, Allied Vision Technology, Newburyport, États-Unis).
La lumière polarisée p frappe directement le fond de la lame de verre revêtue d’or à travers le prisme et la caméra capture le faisceau réfléchi pour générer des images SPR à une vitesse de 0,828 image par seconde (fps). Lors du choix d’un grossissement 4X dans un objectif accordable, le champ de vision était d’environ 2 × 2 mm2.
Préparation de la puce du capteur
Chaque puce a été lavée avec de l’éthanol à 75% et de l’eau désionisée (DIW), suivie d’une exposition aux UV pendant 30 min pour éliminer la contamination de surface et les stériliser avant chaque expérience. Une chambre de silicium Flexi-permanente (Greiner Bio-One) a été placée au-dessus de la puce d’or pour servir de puits de culture cellulaire. Pour obtenir la modification de surface avant l’ensemencement cellulaire, une solution de collagène 100 µg / mL à 150 µL a été ajoutée à la chambre et maintenue dans un incubateur pendant 2 h. La puce a ensuite été rincée à l’eau désionisée deux fois et au DMEM deux fois avant l’ensemencement cellulaire. Pour donner une bonne forme aux cellules, la puce a été incubée dans le milieu de croissance pendant 36 h. Le milieu de croissance a ensuite été remplacé par une solution tampon de PBS pendant 10 min pour que les cellules atteignent un équilibre.
Système d’écoulement
Un système de perfusion de médicament multicanal piloté par gravité a été appliqué à l’injection et à la commutation de la solution. Le débit est de 300 µL/min et la vitesse de commutation de la solution autour des cellules peut atteindre 1-2 s.
Étalonnage de la sensibilité
Une puce de capteur a été préparée comme décrit dans la partie précédente sans modification de surface ni ensemencement des cellules. Tout d’abord, le DIW a coulé sur la puce pendant environ 60 s. Ensuite, il a été remplacé par une solution d’éthanol à 1% (v / v) pendant 60 s. En tant que solution d’étalonnage la plus couramment utilisée, l’éthanol à 1% est connu pour augmenter l’angle SPR du DIW de 60 mDeg. Les résultats expérimentaux ont montré que l’intensité SPR augmentait en conséquence de 96 UI (Figure 1C), ce qui correspond à une sensibilité de 1,6 ΔI.U./mDeg.
Résultats et discussion
La membrane cellulaire (également appelée membrane cytoplasmique), constituée d’une bicouche lipidique avec des protéines intégrées, est une membrane semi-perméable qui enveloppe le cytoplasme d’une cellule. Les étapes de fixation et de perméabilisation des échantillons de cellules et de tissus, qui pourraient modifier la perméabilité de la membrane cellulaire, sont des procédures cruciales qui pourraient déterminer les succès des tests immunofluorescents ou immunohistochimiques. En plus de cela, la qualité des anticorps et la procédure d’immunoréaction sont d’autres déterminants clés de ce type d’expériences. SPR a la particularité que l’angle de résonance et l’indice de réfraction (RI) près de la surface de détection sont très sensibles à la densité de masse de la couche superficielle dans l’interface métal moyen. Par conséquent, les variations de densité de masse de la cellule se produisant sur ou à proximité du film métallique (~ 200 nm) pourraient être enregistrées de manière synchrone en mesurant l’intensité de la lumière réfléchie. En utilisant la technique d’imagerie par résonance plasmon de surface, nous avons exploré la distribution dynamique de la densité de masse cellulaire avec des résolutions spatiales et temporelles élevées et une sensibilité fiable dans les processus de fixation et de perméabilisation dans cette étude.
Perte de Densité de Masse initiale dans la Fixation cellulaire par PFA
La première étape pour préparer des échantillons biologiques pour une analyse immunofluorescente ou immunohistochimique est généralement la fixation. Et les fixateurs les plus couramment utilisés pour ces types de tests sont les fixateurs de réticulation comme le PFA qui fonctionne en générant des liaisons chimiques covalentes entre les protéines dans les cellules ou les tissus. Nous avons donc étudié l’influence du traitement par PFA sur la densité de masse cellulaire. Des cellules vivantes BT-474 ont été cultivées sur des lamelles recouvertes d’un film d’or d’une épaisseur de 50 nm. Une image SPR représentative contenant des cellules uniques est fournie à la figure 2A. Les signaux SPR de chaque cellule peuvent être obtenus en choisissant une région d’intérêt dans l’image SPR qui correspond à la morphologie de la cellule étudiée. Dans une expérience typique, lorsque la solution s’écoulait sur les cellules, des capteurs SPR des cellules ont été obtenus en analysant chaque cellule comme le montre la figure 2B (courbe noire). Au cours des 242 s précédentes, un tampon PBS sans PFA circulait sur les cellules et la ligne de base était déterminée par la stabilité du système (source lumineuse et stabilité mécanique) et les signaux de micromotion inhérents générés par les cellules vivantes. Une solution de PFA a ensuite été introduite à la 242e seconde, ce qui a immédiatement augmenté le signal SPR en raison de l’indice de réfraction relativement important de la solution de PFA à 4% (effet de masse). La solution de PFA a fonctionné pendant encore 17 minutes pour obtenir une fixation suffisante. À la 1237e seconde, la solution de PFA a été remplacée par une solution de PBS pure. En plus de l’effet de masse réduit, une diminution de l’intensité SPR des cellules individuelles a été trouvée en comparant les signaux avant (0-242) et après (1237-1545) les traitements de PFA et le pourcentage de perte de masse a été obtenu en divisant la valeur de diminution à la valeur initiale. Les sensongrammes SPR du fond (une région adjacente sans adhérence cellulaire, courbe bleue) et une seule cellule traitée avec du PBS pendant 1500 s (courbe grise) sont également représentés sur la figure 2B. L’analyse statistique sur 30 cellules révèle une perte de densité massique moyenne de 10 ± 5% comme indiqué sur la figure 2C. Il a également été constaté qu’après le traitement par PFA, le niveau de fluctuation de base du signal SPR était considérablement réduit de moitié, voire des deux tiers, suggérant la perte de micromotions et la fixation des cellules traitées comme le montre la figure 2D. De tels signaux de micromotion étaient générés par un ensemble d’activités cellulaires dynamiques provenant de différents composants cellulaires, y compris le squelette, les membranes et les organites. La fixation a mis fin à ces activités biologiques et a donc éliminé les signaux de micromotion, accompagnant une fluctuation d’intensité significativement réduite des sensogrammes SPR des cellules individuelles.
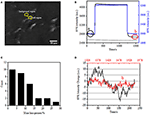
Figure 2. Processus de fixation cellulaire. (A) Image SPRi des cellules BT-474. (B) Signaux SPR de cellule unique (courbe noire) et de fond (courbe bleue) subissant un processus de commutation de solution: tampon PBS à 4% PFA à tampon PBS. Signal SPR d’une cellule unique traitée avec du PBS pendant 1500 s (courbe de gris). C) Répartition des pertes de masse de 30 cellules individuelles. (D) Niveau sonore de la cellule avant (a) et après (b) le traitement PFA.
Réponse à la pression osmotique dans la fixation cellulaire par PFA
La structure intégrée de la membrane cellulaire, une membrane semi-perméable, régule l’homéostasie d’une cellule pour atteindre l’équilibre de la pression osmotique physiologique. Il a également été constaté que le traitement par PFA avait la capacité de détruire l’intégrité de la membrane, comme le montre la figure 3. Lorsque le tampon autour de la cellule cible s’est transformé en une solution de saccharose de 25 mM en <1 s via un système de perfusion médicamenteuse, un environnement de culture cellulaire hypertonique a été créé. Pour les cellules vivantes, l’exposition à une solution hypertonique a déclenché une série de réponses physiologiques pour équilibrer la pression osmotique intracellulaire et extracellulaire, qui a été étudiée en détail dans nos travaux précédents (Wang et al., 2012a). Dans cette étude, un capteur SPR typique de cellules physiologiques uniques de BT-474 est fourni à la figure 3A. Lors de l’exposition à une solution de saccharose hypertonique, les cellules traitées ont d’abord subi un rétrécissement pressant, entraînant une augmentation progressive de l’intensité de la SPR jusqu’à atteindre un plateau. Il a suggéré l’augmentation de la densité de masse en raison du rétrécissement cellulaire et de la collecte des composants subcellulaires vers le fond de la lamelle de culture d’or. L’augmentation progressive de l’intensité de la RPS par stimulation hypertonique est une sorte de régulation physiologique de la pression osmotique cellulaire, indiquant ainsi l’intégrité physiologique de la membrane cellulaire. Lorsque l’intégrité de la membrane a été détruite, il a été constaté que l’introduction d’une solution de saccharose hypertonique augmentait immédiatement l’intensité de la RPS en un temps beaucoup plus court, comme le montre la figure 3B. C’est parce que les molécules de sucre pénètrent librement dans les cellules sans résistance de la membrane semi-perméable et augmentent immédiatement l’indice de réfraction local (effet de masse). Il est clair que, alors que l’augmentation lente de l’intensité du SPR reflétait la régulation osmotique physiologique (Figure 3A), le saut rapide a démontré que la membrane cellulaire avait été endommagée pour permettre l’entrée libre de petites molécules de sucre (Figure 3B).

Figure 3. Réponses de pression osmotique des cellules. (A) Réponse d’une cellule vivante à 25 mm de saccharose. (B) Réponse de la même cellule fixée (10 min) à 25 mm de saccharose.
Perte importante de densité de masse dans la perméabilisation cellulaire par Triton
Au stade de fixation précédent, une densité de masse cellulaire initiale n’a diminué que de ~10% (Figure 2C). Il est raisonnable de supposer que la fixation du PFA n’a que légèrement détruit l’intégrité de la membrane et augmenté la perméabilité des petites molécules. La majorité des composants intracellulaires doivent encore être hébergés dans la membrane cytoplasmique. Nous avons ensuite étudié l’influence d’un détergent de perméabilisation typique, 1% de Triton X-100, sur des cellules qui ont été fixées avec du PFA pendant 17 min auparavant. Un capteur SPR représentatif de cellules individuelles pendant l’exposition à 1% de Triton X-100 est illustré à la figure 4A. L’introduction de Triton X-100 a augmenté l’intensité de la SPR suivie d’une diminution progressive. La première augmentation est une conséquence de l’augmentation de l’indice de réfraction de la solution en vrac, et la diminution qui a suivi a indiqué la perte progressive de la densité de masse due à la perméabilisation cellulaire. La densité massique réduite était plus abondante lorsque l’on compare le changement d’intensité SPR avant (0-300 s) et après l’introduction du détergent (1 300-1 800 s). L’analyse sur 30 cellules individuelles a démontré que le traitement par Triton X-100 a entraîné une diminution importante de la densité massique de 20 ± 5 % après la fixation du PFA, comme le montrent la figure 4D et le tableau 1. Il est clair que le détergent Triton X-100 a éliminé beaucoup plus de lipides membranaires cellulaires et a gravement détruit l’intégrité de la membrane dans cette étape de perméabilisation. Cela a entraîné la libération de plus de composants intracellulaires, en particulier de macromolécules, à partir des cellules. De plus, cela permet aux grosses molécules comme les anticorps de pénétrer à l’intérieur de la cellule lors de la prochaine étape d’immunoréaction. Bien que l’intensité SPR de la lixiviation de petites molécules ait été détectée après la fixation du PFA, la perméabilisation à l’aide du détergent Triton X-100 a clairement solubilisé les lipides et rendu les cellules beaucoup plus perméables aux mouvements des macromolécules dans et hors du corps cellulaire.
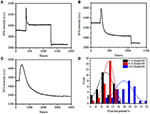
Figure 4. Courbes de perte de masse de cellules traitées avec différentes solutions de concentration (A) 1,0%, (B) 0,5%, (C) 0,1%. D) Répartition des pertes de masse de 30 cellules individuelles dans des conditions différentes.

Tableau 1. Un résumé des variations de la perte de densité de masse des cellules statistiques dans différentes conditions.
Il a été constaté que la perte de densité massique est un processus assez rapide, qui s’est produit en quelques minutes en phase de perméabilisation (Figure 4A). La diminution de la densité de masse a suivi à peu près une décroissance monotone dans une période de temps de 126 s. Les capteurs typiques de cellules individuelles inférieures à 0,5 et 0,1% de Triton X-100 sont affichés dans les figures 4B, C, respectivement. Le processus de perméabilisation est devenu beaucoup plus lent lors de la réduction de la concentration de détergent. Il a fallu 126 510 2 600 s pour que les trois types de cellules traitées terminent la perte de masse.
Conclusion
En résumé, la redistribution dynamique de la densité de masse cellulaire dans les processus de fixation et de perméabilisation a été explorée de manière sensible en utilisant une configuration SPRi basée sur des prismes avec des résolutions spatiales et temporelles élevées. Le PFA fixateur pourrait initialement augmenter la perméabilité de la membrane cytoplasmique dans une certaine mesure en raison de sa capacité à fixer les protéines cellulaires dans les protéines membranaires et intra-cellulaires. Il a été soutenu par (1) la diminution de la densité massique d’environ 10% après un traitement de fixation de 17 minutes dans une solution de PFA à 4%, et (2) la réponse cellulaire éliminée à la solution hypertonique, qui a démontré la destruction de l’intégrité cellulaire en petites molécules comme les sucres. Le détergent Triton X-100 est supérieur au fixateur PFA pour solubiliser les lipides et donc augmenter la perméabilité de la membrane cellulaire, ce qui entraîne une perte plus importante de la densité de masse due à la libération non seulement de petites molécules mais aussi de grosses molécules et éventuellement de certains organites tels que des vésicules. En outre, le taux de perte de masse est positivement corrélé avec la concentration de Triton X-100. Ces résultats ont fourni une compréhension quantitative et dynamique de l’influence de la fixation et de la perméabilisation sur la densité de masse cellulaire et l’intégrité de la membrane, avec des implications pour l’optimisation des conditions pour les expériences biologiques unicellulaires, telles que les tests immunofluorescents et immunohistochimiques.
Contributions des auteurs
RC, Y-WS et WW ont conçu les expériences. RC, FZ, ML et XW ont effectué les expériences. RC, Y-WS et WW ont écrit le document. RC, FZ, Y-WS et WW ont discuté des résultats et analysé les données.
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
L’éditeur de gestion a déclaré une affiliation partagée, bien qu’aucune autre collaboration, avec les auteurs WW, RC, ML et XW au moment de l’examen.
Remerciements
Nous remercions le soutien financier de la Fondation Nationale des Sciences Naturelles de Chine (Subvention n ° 21522503).
Abadian, P. N., Kelley, C. P., et Goluch, E. D. (2014). Analyse et détection cellulaires à l’aide de techniques de résonance plasmonique de surface. Anal. Chem. 86, 2799–2812. doi: 10.1021/ac500135s
Résumé publié/ Texte intégral croisé /Google Scholar
Cullen, D.C., Brown, R. G. W. et Lowe, C. R. (1987). Détection de la formation d’immuno-complexes par résonance de plasmon de surface sur des réseaux de diffraction revêtus d’or. Biocapteurs 3, 211-225. doi: 10.1016/0265-928X (87) 85002-2
Résumé publié / Texte intégral croisé /Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., et Wang, P. (2016). Dispositif microfluidique à deux compartiments pour la détection de cellules vivantes à long terme basée sur la résonance plasmonique de surface. Biomicrofluidique 10:044109. doi: 10.1063 / 1.4960487
Résumé PubMed / Texte intégral croisé / Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J. et Roller, P. P. (1985). Fixation du formaldéhyde. J. Histochem. Cytochème. 33, 845–853. doi: 10.1177 / 33.8.3894502
Résumé publié / Texte intégral croisé /Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Imagerie des contacts cellule/substrat de cellules vivantes avec microscopie par résonance plasmonique de surface. Biophys. J. 76, 509-516. doi: 10.1016/S0006-3495 (99) 77219-X
Résumé PubMed | Texte intégral croisé | Google Scholar
Homola, J. (2008). Capteurs de résonance plasmon de surface pour la détection d’espèces chimiques et biologiques. Chem. Rév. 108, 462-493. doi: 10.1021/cr068107d
Résumé publié | Texte intégral croisé / Google Scholar
Jamur, M. C., et Oliver, C. (2010). « Perméabilisation des membranes cellulaires », in Immunocytochemical Methods and Protocols, éd. C. Oliver et M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007/978-1-59745-324-0_9
CrossRef Texte intégral /Google Scholar
Joshi, S. et Yu, D. (2017). « Chapitre 8 – Immunofluorescence », dans Basic Science Methods for Clinical Researchers, dir. M. Jalali, F. Y. L. Saldanha et M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016/B978-0-12-803077-6.00008-4 il s’agit de la première édition de la série de jeux vidéo en ligne de l’année 2018. Formaldéhyde, formol, paraformaldéhyde et glutaraldéhyde: ce qu’ils sont et ce qu’ils font. Micro. Aujourd’hui 8, 8-13. doi: 10.1017|S1551929500057060
CrossRef Texte intégral/Google Scholar
Koley, D., et Bard, A. J. (2010). Effets de la concentration de Triton X-100 sur la perméabilité membranaire d’une seule cellule HeLa par microscopie électrochimique à balayage (SECM). Proc. Natl. Acad. Sci. États-Unis 107, 16783-16787. doi: 10.1073/pnas.1011614107
Résumé publié par PubMed / Texte intégral croisé / Google Scholar
Liedberg, B., Nylander, C. et Lunström, I. (1983). Résonance plasmon de surface pour la détection de gaz et le biocapteur. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Texte intégral |Google Scholar
Méjard, R., Griesser, H. J. et Thierry, B. (2014). Biocapteurs optiques pour des études cellulaires sans étiquette. Trac Tendances Anal. Chem. 53, 178–186. doi: 10.1016 /j. trac.2013.08.012
CrossRef Texte intégral / Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y. et Li, J. (2018). Imagerie sans étiquette de la réponse induite par les récepteurs du facteur de croissance épidermique dans des cellules vivantes uniques. Analyste 143, 5264-5270. doi: 10.1039/C8AN01534A
Résumé publié / Texte intégral croisé / Google Scholar
Phillips, K. S. et Cheng, Q. (2007). Progrès récents dans les techniques de bioanalyse basées sur la résonance plasmon de surface. Anal. Bioanal. Chem. 387, 1831–1840. doi: 10.1007/s00216-006-1052-7
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
Rothenhäusler, B., et Knoll, W. (1988). Microscopie de surface-plasmon. Nature 332, 615-617. doi: 10.1038/332615a0
CrossRef Texte intégral/Google Scholar
Smith, J. T., Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B. et Reichert, W. M. (2004). Mesure de la migration cellulaire sur des gradients de fibronectine liés à la surface. Langmuir 20, 8279-8286. doi: 10.1021/la0489763
Résumé publié | Texte intégral croisé / Google Scholar
Su, Y. W. et Wang, W. (2018). Détection de résonance plasmon de surface: des biomolécules purifiées aux cellules intactes. Anal. Bioanal. Chem. 410, 3943–3951. doi: 10.1007/s00216-018-1008-8
Résumé publié / Texte intégral croisé /Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, Royaume-Uni, et Ranganathan, K. (2012). Bases chimiques et physiques de la fixation de routine du formaldéhyde. J. Maxillofac Oral. Pathol. 16, 400–405. doi: 10.4103/0973-029X.102496
Résumé publié | Texte intégral croisé / Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Imagerie, détection et mesure de masse sans étiquette de virus uniques par résonance plasmon de surface. Proc. Natl. Acad. Sci. États-Unis 107, 16028-16032. doi: 10.1073/pnas.1005264107
Résumé PubMed | Texte intégral croisé / Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J. et Tao, N. (2012a). Mapping single-cell-substrate interactions by surface plasmon resonance microscopy. Langmuir 28, 13373-13379. doi: 10.1021/la301712h
Résumé publié | Texte intégral croisé | Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). Mesure et cartographie sans étiquette de la cinétique de liaison des protéines membranaires dans des cellules vivantes uniques. NAT. Chem. 4, 846–853. doi: 10.1038/ nchem.1434
Résumé publié | Texte intégral croisé / Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). In situ drug-receptor binding cinetics in single cells: a quantitative label-free study of anti-tumor drug resistance. Sci. Rép. 4:6609. doi: 10.1038/srep06609
Résumé publié | Texte intégral croisé / Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Détection ultra-sensible et ultra-rapide des réponses entières de cellules cancéreuses vivantes non marquées au paclitaxel avec un biocapteur à base de graphène. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016/j. bns.2018.02.095
CrossRef Texte intégral /Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Résonance plasmon de surface pour le diagnostic clinique cellulaire. Capteurs 14, 4948-4959. doi: 10.3390/s140304948
Résumé publié| Texte intégral croisé/Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W., et Hide, M. (2010). Détection des changements d’indice de réfraction dans des cellules vivantes individuelles au moyen de l’imagerie par résonance plasmon de surface. Biosens. Bioélectron. 26, 674–681. doi: 10.1016 / j. bios.2010.06.065
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Suivi sans étiquette du transport d’organites uniques dans les cellules avec une précision nanométrique à l’aide d’une technique d’imagerie plasmonique. Petit 11, 2878-2884. doi: 10.1002/ smll.201403016
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Quantification of epidermal growth factor receptor expression level and binding cinetics on cell surfaces by surface plasmon resonance imaging. Anal. Chem. 87, 9960–9965. doi: 10.1021/acs.analchem.5b02572
Résumé PubMed / Texte intégral CrossRef /Google Scholar