Frontiers in Chemistry
Introduction
免疫蛍光は、細胞や組織などの生物学的サンプル内の特定の生体分子の分布を可視化する強力な技術です(Joshi and Yu,2017)。 典型的な細胞ベースの免疫蛍光アッセイでは、付着細胞は、細胞内の抗体と標的分子との間の特異的な認識と結合を可能にするために蛍光抗体とイン 徹底的なすすぎの後、試料を蛍光顕微鏡下に置き、蛍光画像を得、そこから標的分子の分布を蛍光タグによって報告した。 標的分子への抗体の接近性を促進し、固有の細胞活性を阻害するために、試料は、染色手順の前にしばしば固定され、透過処理された。 それらは、標的分子が細胞質内に位置する場合に特に必要であった。 多くのタイプの試薬の中で、paraformaldehyde(pfa)およびTriton X-100はおそらく固定および透過性化のための最も広く利用された物、それぞれである。 PFAの解重合によりホルムアルデヒド分子が生成し,試料中の蛋白質間に共有結合を形成した。 作用のメカニズムは、アミノ酸残差リジンのいずれかの活性化に依存していた。 PFAはまた、細胞膜の完全性をわずかに損傷するいくつかの脂質を細胞膜中に溶解した(Fox e t a l. ら、1 9 8 5;Thavarajah e t a l. 2012年、Kiernan、2018年)。 有効な非イオンの洗剤としてTriton X-100は、細胞膜が蛍光抗体に透過性になったように、細胞膜からの脂質を分解できます。 透過性化ステップは、抗体のような大きな分子が細胞内に入ることを可能にするために、ポリオキシエチレン部分からなるその荷電していない親水性の頭部基のために、より多くの細胞膜脂質を除去した(Jamur And Oliver、2010;Koley and Bard、2010)。 細胞の固定と透過処理の概略図を図1Dに示します。 免疫蛍光および免疫組織化学において固定および透過化が日常的な手順になっているにもかかわらず,単一細胞レベルでの膜の完全性および細胞質量密度に及ぼす影響を定量的に明らかにするための非常にまれな努力がなされている。
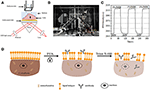
図1. プリズムベースのSPRイメージングセットアップ。 (A)実験セットアップの概略図。 (B)装置の写真。 (C)感度検量線。 (D)細胞固定および透過性化の概略図。
表面プラズモン共鳴(SPR)は、1980年代の発明以来、一対の分子間の結合速度論を決定するための一般的で強力な技術であった(Liedberg et al. ら、1 9 8 3;Cullen e t a l., 1987). これは、高い時間分解能を有するリアルタイム定量的速度論的測定、拡張されたデバイスとの互換性、および最も重要なのは、ラベルフリーのその本質的な特徴を含む、その顕著な利点に起因する(Rothenhäusler and Knoll、1988;Phillips and Cheng、2007;Homola、2008;Abadianら、1989年、1989年、1989年、1989年、1989年、1989年、1989年、1989年、1989年)。 ら、2 0 1 4;Mejardら、2 0 1 4;Mejardら、 ら、2 0 1 4;Yanaseら、2 0 1 5;Yanaseら、, 2014; SuとWang、2018)。 初期のアプリケーションは、主にSPRセンシング基板(金コーティングされたガラススライド)上に精製された分子を固定化することにより、生体分子相互 このようなex situ研究は、労働集約的な精製手順を必要とするだけでなく、生物における自然の相互作用を反映しない結果をもたらした(Phillips and Cheng、2007;Homola、2008)。 種々のSPRイメージング(Spri)システムにおける技術的進歩と、単一細胞イメージングおよび分析における科学的動機付けの両方によって駆動され、prismおよび客観 ら,2 0 1 0,2 0 1 2a;Yanase e t a l. ら、2 0 1 0;Yang e t a l. ら、2 0 1 5;Zhang e t a l., 2015). それぞれには独自のメリットがあります。 後者はより高い空間分解能を有し、前者はより良好な感度を有する。 種々のタイプの生理学的および生物学的刺激の間に、単一の生きた細胞の時間経過したSPR画像を監視することによって、細胞−基質相互作用に関する重要な空間的および動的情報(Giebel et al. ら、1 9 9 9)、細胞移行(Smith e t a l. ら、2 0 0 4)、浸透圧応答(Wang e t a l. ら、2 0 1 2a)、リガンド−受容体結合速度論(Wang e t a l. ら,2 0 1 2b,2 0 1 4)、シグナル伝達経路(Deng e t a l. ら、2 0 1 6)、タンパク質活性化ダイナミクス(Pengら、2 0 1 7)、pengら、2 0 1 8)。 ら、2 0 1 8)、および生きている癌細胞薬物応答(Wang e t a l. ら、2018)が得られている。 例えば、既存の研究は、Spri技術が、単一細胞レベルでの質量密度ならびに膜の完全性をマッピングすることが可能であることを明確に示している(Yanase e t a l. ら、2 0 1 0;Wang e t a l. ら、2 0 1 2b;Yang e t a l., 2015). Spriの画像コントラストは屈折率の細胞内分布に由来し,これは局所質量密度によって大まかに決定された。 対応する抗原を発現する細胞膜への特異的抗体の結合、または特定の化学物質で生きた細胞を刺激することは、不均一かつ動的な方法で単一細胞の質量密度を変化させることが見出された(Wang et al.,2012a,b). 単一の生細胞の高張溶液への曝露は、細胞の収縮を誘導することが見出され、細胞膜の優れた完全性を示している(Wang et al.,2012a). しかし、固定および透過処理が単一細胞のSPR画像にどのように影響するかは不明のままである。
本研究では、4%PFA溶液と1%Triton X-100溶液で細胞を連続的に処理したときに、数十の単一の生きている細胞の時間経過SPR画像を連続的に記録するため 単一細胞の質量密度は、平均化されたSpri信号によって決定された。 細胞を高張溶液に曝露することによって膜の完全性を評価した。 これは、わずかに減少した質量密度に加えて、ことがわかった<10%、pfa処理は大幅に糖分子の暴露時の浸透圧応答の損失によって示されるよ トリトンX-100によるその後の処理は、しかし、大幅に膜の完全性に深刻な破壊を示唆し、別の20%の質量密度を減少させました。
材料および方法
材料
ダルベッコのリン酸緩衝生理食塩水(PBS、Gibco)、ショ糖(Sinopharm Chemical Reagent Co.、Ltd)、Triton X-100(アラジン)、パラホルムアルデヒド(上海Lingfengの化学試薬Co.,Ltd)。 全ての試薬をPBSに溶解した。BT−4 7 4細胞を、1 0%ウシ胎児血清(FBS、Invitrogen)、1 0 0単位/mLペニシリンおよび1 0 0μ g/mLストレプトマイシン(Invitrogen)を含むDubelco改変イーグル培地(DMEM、Invitrogen)中で、3 7℃、5%CO2および7 0%相対湿度 細胞は、0.25%トリプシン溶液(Gibco)で処理することにより、70-80%コンフルエントであったときに通過した。
プリズムベースのSPRイメージングセットアップ
SPRiシステムの概略図と写真を図1A、Bに示します。*光源:670nm発光ダイオード(L7868-01、浜松、日本)および温度制御された取り付けソケット(LDM21、Thorlabs、Newton、米国)。
•光学部品(エドマンドオプティクス、米国):センサーチップをオンにした三角形SF-11プリズム(いいえ。 Fisherbrandからの1つのBK7ガラス)、集中レンズ、偏光子および調整可能なレンズ。*カメラ:充電結合デバイスカメラ(Pike F032B、Allied Vision Technology、Newburyport、USA)。
p偏光は、プリズムを介して金でコーティングされたガラススライドの底に直接当たり、カメラは0.828フレーム/秒(fps)の速度でSPR画像を生成するために反射 調整可能なレンズで4倍の倍率を選択すると、視野は〜2×2mm2でした。
センサーチップ調製
各チップを75%エタノールおよび脱イオン水(DIW)で洗浄し、30分間UV露光して表面汚染を除去し、各実験の前に滅菌した。 金チップの上にFlexi-Permシリコンチャンバー(Greinerbio-Onee)を置き,細胞培養井戸として機能させた。 細胞播種前に表面改質を達成するために、100μ g/mL150μ lのコラーゲン溶液をチャンバに加え、インキュベーター内に2時間保持した。 細胞を良好な形状にするために、チップを増殖培地中で36時間インキュベートした後、増殖培地を、細胞のバランスを達成するために10分間PBS緩衝液
フローシステム
重力駆動マルチチャネル薬物灌流システムは、溶液の注入およびスイッチに適用されました。 流量は300μ l/分であり、細胞の周りの溶液スイッチング速度は1-2秒に達することができる。
感度校正
表面改質および細胞播種なしで前の部分に記載されているようにセンサチップを調製した。 最も一般的に使用される校正溶液の一つとして、1%エタノールはDIWのSPR角を60mDeg増加させることが知られている。 実験結果は、SPR強度がそれに応じて96I.U.(図1C)によって増加し、1.6Δ Iの感度に対応することを示した。U.|mDeg.
結果と考察
細胞膜(細胞質膜とも呼ばれる)は、タンパク質が埋め込まれた脂質二重層からなり、細胞の細胞質を囲む半透過性膜である。 細胞膜の透過性を変化させる可能性のある細胞および組織試料の固定および透過化ステップは、免疫蛍光または免疫組織化学的アッセイの成功を決定することができる重要な手順である。 これに加えて、抗体の品質および免疫反応手順は、これらの種類の実験に対する他の重要な決定要因である。 SPRは,センシング表面近傍の共鳴角と屈折率(R i)の両方が媒体-金属界面における表面層の質量密度に非常に敏感であるという特徴を有する。 したがって、反射光の強度を測定することにより、金属膜(〜200nm)上またはその近くで起こるセルの質量密度変動を同期的に記録することができます。 表面プラズモン共鳴イメージング法を用いて,固定と透過プロセスの両方において,高い空間的および時間的分解能と信頼性の高い感度を有する細胞質量密度の動的分布を検討した。pfaによる細胞固定における初期質量密度損失
免疫蛍光または免疫組織化学的分析のための生物学的サンプルを調製するための最初のステ そしてこれらの種類の試金のための最も一般的な固定剤は細胞またはティッシュの蛋白質間の共有結合の化学結合の生成によって働くPFAのよ そこで,pfa処理が細胞質量密度に及ぼす影響を調べた。 生きているBT-474細胞は50nmの厚さの金のフィルムによって塗られるcoverslipで培養されました。 各細胞のSPR信号は、調査された細胞の形態に一致するSPR画像内の関心領域を選択することによって得ることができる。 典型的な実験では、溶液が細胞上に流れたとき、図2B(黒い曲線)に示すように各細胞を分析することによって細胞のSPRセンサグラムが得られた。 前の242sでは、PFAのないPBSの緩衝は細胞に流れ、ベースラインはシステム安定性(光源および機械安定性)および生きている細胞によって発生する固有の微 次いで、PFA溶液を2 4 2秒目に導入し、これは、4%PFA溶液の比較的大きな屈折率(バルク効果)のために、SPR信号を直ちに増加させた。 PFA溶液は、十分な固定を達成するために、さらに1 7分間実行した。 第1 2 3 7秒で、PFA溶液を純粋なPBS溶液に戻した。 減少したバルク効果に加えて、単一細胞のSPR強度の減少は、PFA処理の前(0-242)と後(1237-1545)の信号を比較するときに発見され、質量損失パーセントは、減少値を初期値 背景(細胞接着のない隣接領域、青色の曲線)と1,500秒の間にPBSで処理された単一細胞(灰色の曲線)のSPR sensongramsも図2Bに示されています。30細胞の統計分析は、図2Cに示されているように10±5%の平均質量密度損失を明らかにしています。 また、PFA処理後、SPR信号のベースライン変動レベルが有意に半分または二三によって減少したことが判明し、図2Dに示すように、処理された細胞のマイクロモーションシグナルの損失と固定を示唆している。 固定はこのような生物学的活性を終了し、したがって、単一細胞のSPRセンソグラムの有意に減少した強度変動に伴うマイクロモーションシグナルを
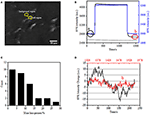
細胞固定プロセス。 (A)BT−4 7 4細胞のSpri画像。 (B)溶液切換プロセスを受ける単一セル(黒色曲線)および背景(青色曲線)のSPR信号:PBS緩衝液から4%PFAへのPBS緩衝液へのpbs緩衝液。 1,500s(灰色のカーブ)の間にPBSと扱われる単一セルのSPR信号。 (C)30個の単一セルの質量損失分布。 (D)(a)PFA処理前および(b)pfa処理後の細胞の騒音レベル。
Pfaによる細胞固定における浸透圧応答
半透膜である細胞膜の統合構造は、細胞の恒常性を調節し、生理学的浸透圧のバラン PFA処理はまた、図3に示すように膜の完全性を破壊する能力を有することが見出された。 標的細胞の周りの緩衝液が薬物灌流システムを介して<1秒で25mMスクロース溶液に変化すると、高張細胞培養環境が作成されました。 生細胞の場合、高張溶液への曝露は、細胞内および細胞外浸透圧のバランスをとるための一連の生理学的応答を誘発し、これは我々の以前の研究(Wang et al.,2012a). この研究では、単一の生理的なBT-474細胞の典型的なSPRセンソグラムは、図3Aに提供されています。高張ショ糖溶液への暴露時に、処理された細胞は、まずプラトーに達されたまでSPR強度の漸進的な増加につながる、圧迫収縮を受けました。 これは、細胞の収縮と金培養カバースリップの底に向かって収集する細胞内成分の結果として増加した質量密度を示唆した。 従ってhypertonic刺激によるSPRの強度の漸進的な増加は一種の細胞浸透圧のための生理学的な規則で、細胞膜の生理学的な完全性を示します。 膜の完全性が破壊されたとき、高張性ショ糖溶液の導入は、図3Bに示すように、すぐにはるかに短い時間でSPR強度を増加させることが見出された。 これは、糖分子が半透膜から抵抗することなく細胞内に自由に浸透し、すぐに局所屈折率を増加させた(バルク効果)ためである。 SPR強度のゆっくりとした増加は生理学的浸透圧調節を反映していたが(図3A)、急速なジャンプは細胞膜が損傷して小さな糖分子の自由な侵入を可能にしたことを示していた(図3B)ことは明らかである。

図3. 細胞の浸透圧応答。 (A)2 5m Mショ糖に対する生細胞の応答。 (B)同じ細胞の応答を2 5m Mショ糖に固定した(1 0分)。
トリトンによる細胞透過性における実質的な質量密度損失
前の固定段階では、初期の細胞質量密度はわずか-10%減少した(図2C)。 PFA固定は膜の完全性をわずかに破壊し,小分子の透過性を増加させただけであると推測することは合理的である。 細胞内成分の大部分は依然として細胞質膜内に保持されるべきである。 我々はその後、典型的な透過性洗剤、1%トリトンX-100、以前に17分間PFAで固定されている細胞の影響を研究しました。 1%Triton X-100への曝露中の単一細胞の代表的なSPRセンソグラムを図4Aに示します。Triton X-100の導入はSPR強度を増加させ、続いて徐々に減少させました。 最初の増加はバルク溶液の屈折率の増加の結果であり,その後の減少はセル透過性による質量密度の緩やかな損失を示した。 減少した質量密度は、前(0–300s)と洗剤(1,300-1,800s)の導入後のSPR強度変化を比較すると、より豊富であった。 30個の単一細胞についての分析は、図4Dおよび表1に示すように、トリトンX-100処理は、PFA固定後にさらに20±5%の実質的な質量密度の減少を作 洗剤Triton X-100は大いにより多くの細胞膜の脂質を除去し、厳しくこのpermeabilizationの段階の膜の完全性を破壊したことは明らかです。 これにより、より多くの細胞内成分、特に高分子が細胞から放出された。 また、これにより、抗体のような大きな分子が次の免疫反応段階で細胞内に入ることができます。 PFA固定後に小分子浸出のSPR強度が検出されたが、Triton X-100洗剤を用いた透過性化は、脂質を明確に可溶化し、細胞体の内外の高分子の動きに対して細胞をはるかに透過性にした。
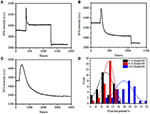
図4. 異なる濃度溶液で処理した細胞の質量損失曲線(A)1.0%、(B)0.5%、(C)0.1%。 (D)異なる条件での30個の単一セルの質量損失分布。テーブル1

さまざまな条件での統計セルの質量密度損失の変動の要約。
質量密度の損失はかなり急速なプロセスであり、透過化段階で数分で発生することがわかりました(図4A)。 質量密度の減少は、おおよそ126秒の期間内に単調崩壊に続いた。0.5および0.1%トリトンX-100以下の単一細胞の典型的なセンサーグラムは、それぞれ図4B、Cに表示されている。 洗剤の濃度を低下させると,透過処理ははるかに遅くなった。 処理された三種類の細胞が質量損失を終了するのに126,510,2,600秒かかりました。
結論
要約すると、固定および透過プロセスの両方における細胞質量密度の動的再分布は、高い空間および時間分解能を有するプリズムベース 固定剤PFAは,膜および細胞内蛋白質の両方に細胞蛋白質を固定する能力があるため,最初は細胞質膜の透過性をある程度増加させる可能性がある。 これは、(1)-10%4%PFA溶液中で17分固定処理後の質量密度の減少、および(2)糖のような小分子への細胞の完全性の破壊を示した高張溶液への排除された細胞 洗剤トリトンX-100は、脂質を可溶化し、したがって、細胞膜透過性を増加させることで固定剤PFAよりも優れており、小分子だけでなく、大きな分子やおそらく小胞のようないくつかのオルガネラの放出による質量密度のより実質的な損失を伴う。 また、質量損失の速度は、トリトンX-100濃度と正の相関があります。 これらの結果は、免疫蛍光および免疫組織化学的アッセイなどの単一細胞生物学的実験のための条件を最適化するための意味で、細胞の質量密度と膜の完全性に固定と透過性の影響について定量的および動的な理解を提供した。
著者の貢献
RC、Y-WS、およびWWは実験を設計しました。 RC、FZ、ML、およびX Wは実験を行った。 RC、Y-WS、WWが論文を書いた。 RC,FZ,Y-W sおよびWWは結果を議論し,データを分析した。
利益相反に関する声明
著者らは、この研究は、利益相反の可能性と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
ハンドリングエディタは、レビュー時に著者WW、RC、ML、およびXWとの共有提携を宣言しましたが、他のコラボレーションはありませんでした。
謝辞
私たちは、中国の国家自然科学財団(助成金第21522503号)からの財政的支援に感謝します。
div とができるようになりました。 表面プラズモン共鳴技術を用いた細胞分析および検出。 アナル… ケム 86, 2799–2812. doi:10.1021/ac500135s
PubMed Abstract|CrossRef Full Text/Google Scholar
Cullen,D.C.,Brown,R.G.W.,And Lowe,C.R.(1987). 金被覆回折格子上の表面プラズモン共鳴による免疫複合体形成の検出。 バイオセンサー3、211-225。 doi:10.1016/0265-928X(87)85002-2
PubMed Abstract|CrossRef Full Text/Google Scholar
Deng,S.,Yu,X.,Liu,R.,Chen,W. およびWang,P.(2016)。 表面プラズモン共鳴に基づく長期生細胞検出のための二コンパートメントマイクロ流体デバイス。 10:044109. doi:10.1063/1.4960487
PubMed Abstract|CrossRef Full Text|Google Scholar
Fox,C.H.,Johnson,F.B.,Whiting,J.,And Roller,P.P.(1985). ホルムアルデヒド固定。 J.Histochem. サイトケム 33, 845–853. doi:10.1177/33.8.3894502
PubMed Abstract|CrossRef Full Text|Google Scholar
Giebel,K.F.,Bechinger,C.,Herminghaus,S.,Riedel,M.,Leiderer,P.,Weiland,U.,et al. (1999). 表面プラズモン共鳴顕微鏡による生きた細胞の細胞/基質接触のイメージング。 バイオフィス・バイフィス・バイフィス J.76,509-516. doi:10.1016/S0006-3495(99)77219-X
Pubmed Abstract|CrossRef Full Text/Google Scholar
Homola,J.(2008). 化学および生物種の検出のための表面のプラズモン共鳴センサー。 ケム 108,462-493. doi:10.1021/cr068107d
PubMed Abstract|CrossRef Full Text/Google Scholar
Jamur,M.C.,And Oliver,C.(2010). Jamur編「permeabilization o f cell membranes」(Totowa,NJ:Humana Press)、6 3−6 6. doi:10.1007/978-1-59745-324-0_9
CrossRef全文|Google Scholar
Joshi,S.,Yu,D.(2017). “第8章-免疫蛍光、”臨床研究者のための基礎科学方法、eds M.Jalali、F.Y.L.Saldanha、およびM.Jalali(ボストン、MA:Academic Press)、135-150。 ドイ:10.1016/B978-0-12-803077-6.00008-4
CrossRef全文|Google Scholar
Kiernan,J.A.(2018). ホルムアルデヒド、ホルマリン、パラホルムアルデヒド、グルタルアルデヒド:彼らは何であり、彼らは何をす マイクロス 本日8月8日-13日 doi:10.1017/S1551929500057060
CrossRef全文/Google Scholar
Koley,D.,And Bard,A.J.(2010). 走査型電気化学顕微鏡(SECM)による単一HeLa細胞の膜透過性に及ぼすTriton X-100濃度の影響。 プロク… ナトル アカド サイ… U.S.A.107,16783-16787. ドイ:10.1073/pnas.1011614107
PubMed Abstract|CrossRef Full Text|Google Scholar
Liedberg,B.,Nylander,C.,And Lunström,I.(1983). ガスの検出およびbiosensingのための表面のプラズモン共鳴。 センサーアクチュアット 4, 299–304. 土井: 10.1016/0250-6874(83)85036-7
CrossRef全文|Google Scholar
Méjard,R.,Griesser,H.J.,And Thierry,B.(2014). ラベルなしの細胞調査のための光学biosensing。 トラックスアナル… ケム 53, 178–186. doi:10.1016/j.trac.2013.08.012
CrossRef全文|Google Scholar
Peng,Z.,Lu,J.,Zhang,L.,Liu,Y.,Li,J.(2018). 単一の生きている細胞の表皮の成長因子の受容器誘発の応答のラベルなしのイメージ投射。 143,5264-5270 doi:10.1039/C8AN01534A
PubMed Abstract|CrossRef Full Text/Google Scholar
Phillips,K.S.,And Cheng,Q.(2007). 生物分析のための表面プラズモン共鳴ベースの技術の最近の進歩。 アナル… バイオアナルバイオアナル… ケム 387, 1831–1840. ドイ:10.1007/s00216-006-1052-7
PubMed Abstract|CrossRef Full Text|Google Scholar
Rothenhäusler,B.,And Knoll,W.(1988). 表面-プラズモン顕微鏡。 自然332、615-617。 doi:10.1038/332615a0
CrossRef全文|Google Scholar
Smith,J.T. ることができると考えられている。 表面結合フィブロネクチン勾配上の細胞遊走の測定。 Langmuir20,8279-8286. doi:10.1021/la0489763
Pubmed Abstract|CrossRef Full Text/Google Scholar
Su,Y.W.,And Wang,W.(2018). 表面プラズモン共鳴センシング:精製された生体分子から無傷の細胞まで。 アナル… バイオアナルバイオアナル… ケム 410, 3943–3951. ドイ:10.1007/s00216-018-1008-8
PubMed Abstract|CrossRef Full Text|Google Scholar
Thavarajah,R.,Mudimbaimannar,V.K. とができるようになりました。 定期的なホルムアルデヒドの固定の化学および物理的な基礎。 J.オーラルマキシロファック。 パトル 16, 400–405. doi:10.4103/0973-029X.102496
PubMed Abstract|CrossRef Full Text/Google Scholar
Wang,S.,Shan,X.,Patel,U.,Huang,X.,Lu,J.,Li,J.,et al. (2010). 表面プラズモン共鳴による単一ウイルスのラベルフリーイメージング、検出、および質量測定。 プロク… ナトル アカド サイ… U.S.A.107,16028-16032. ドイ:10.1073/pnas.1005264107
Pubmed Abstract|CrossRef Full Text|Google Scholar
Wang,W.,Wang,S.,Liu,Q.,Wu,J.,And Tao,N.(2012a). 表面プラズモン共鳴顕微鏡による単一細胞-基質相互作用のマッピング。 Langmuir28,13373-13379. doi:10.1021/la301712h
PubMed Abstract|CrossRef Full Text/Google Scholar
Wang,W.,Yang,Y.,Wang,S.,Nagaraj,V.J.,Liu,Q.,Wu,J.,et al. (2012b)。 単一の生きている細胞の膜蛋白質の結合の速度論のラベルなしの測定そして地図を描くこと。 ナット ケム 4, 846–853. ドイ:10.1038/nchem.1434
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang,W.,Yin,L.,Gonzalez-Malerva,L.,Wang,S.,Yu,X.,Eaton,S.,et al. (2014). 単一細胞におけるIn situ薬物受容体結合動態:抗腫瘍薬耐性の定量的ラベルフリー研究。 サイ… 4:6609 doi:10.1038/srep06609
PubMed Abstract|CrossRef Full Text/Google Scholar
Wang,Y.,Zhang,S.,Xu,T.,Zhang,T.,Mo,Y.,Liu,J.,et al. (2018). グラフェンベースのバイオセンサーを用いて、パクリタキセルに対する未標識の生きた癌細胞全体の応答を超高感度かつ超高速に検出する。 センサーアクチュアット Bケム 263, 417–425. doi:10.1016/j.snb。2018.02.095
CrossRef全文/Google Scholar
柳瀬Y.,Hiragun,T.,Ishii,K.,Kawaguchi,T.,Yanase,T.,Kawai,M.,et al. (2014). 細胞ベースの臨床診断のための表面プラズモン共鳴。 14,4948-4959 doi:10.3390/s140304948
Pubmed Abstract|CrossRef Full Text|Google Scholar
Yanase,Y.,Hiragun,T.,Kaneko,S.,Gould,H.J. ることを示した。 表面プラズモン共鳴イメージングによる個々の生きている細胞の屈折率の変化の検出。 バイオセンスバイオセンスバイオ バイオエレクトロン・バイオエレクトロン 26, 674–681. doi:10.1016/j。2010.06.065
Pubmed Abstract|CrossRef Full Text|Google Scholar
Yang,Y.,Yu,H.,Shan,X.,Wang,W.,Liu,X.,Wang,S.,et al. (2015). プラズモニックイメージング技術を用いたナノメートルの精度で細胞内の単一オルガネラ輸送のラベルフリー追跡。 小11、2878-2884。 ドイ:10.1002/smll.201403016
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang,F.,Wang,S.,Yin,L.,Yang,Y.,Guan,Y.,Wang,w.,et al. (2015). 表面プラズモン共鳴イメージングによる細胞表面上の表皮成長因子受容体発現レベルおよび結合速度論の定量化。 アナル… ケム 87, 9960–9965. 土井:10.1021/アナルケム5b02572
PubMed要約|CrossRef全文|Google Scholar