16.2: Viral Life Cycles
de Lysogenic Pathway
een betere optie voor sommige bacteriële virussen wordt de lysogenic pathway genoemd. De bacteriofaag die deze optie, evenals een lytische weg hebben, staat bekend als gematigde faag. In deze weg, gaat het virus in rust door in het gastheergenoom te integreren, en transcriptioneel stil te blijven tot milieuvoorwaarden veranderen en een waarschijnlijkheid van meer gastheercellen weerspiegelen om te infecteren (figuur \(\Paginindex{4}\)).
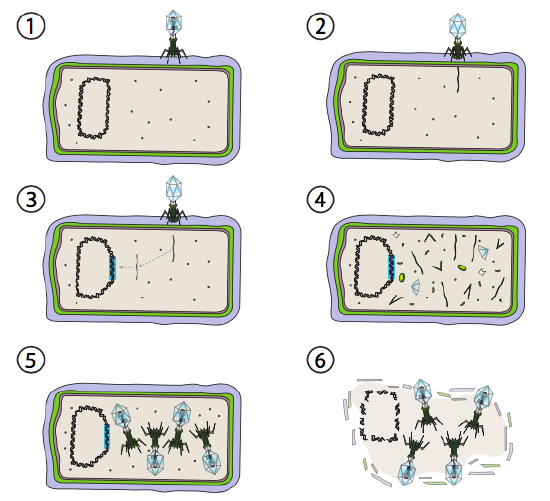
Lambda (λ) is een voorbeeld van een gematigde bacteriofaag. De eerste stadia van besmetting en genoominjectie zijn hetzelfde als de lytic cyclus, maar onder voorwaarden die lysogenie aanmoedigen, wordt het virale genoom in het gastheergenoom in Stap 3 geïntegreerd. In λ integratie in E. coli, komt dit door wederzijdse recombinatie bij een opeenvolging van 15 basisparen voor die als de plaats van att λ wordt bekend en door het genproduct van Int wordt vergemakkelijkt. Zolang de omgevingsomstandigheden niet bevorderlijk zijn voor bacteriële reproductie (en dus beperkt aantal mogelijke gastheercellen), blijft het virale genoom meestal verborgen en inactief. De enige significante uitzondering is een gen dat codeert voor een λ-onderdrukker die de volgende stap voorkomt en het virus inactief houdt.
die volgende stap is de uitsnijding van het λ faag-DNA uit het gastchromosoom, en daaropvolgende replicatie en transcriptie van het virale DNA (figuur \(\Paginindex{4}\), Stap 4). Dan, zoals voorheen, zijn de laatste stappen assemblage en accumulatie van virions, en uiteindelijke afbraak van cellulaire structuur en versie van de virale deeltjes.
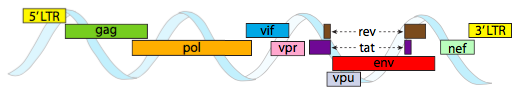
om te kunnen verpakken in de krappe ruimte die door capsiden wordt geboden, moeten virale genomen zeer economisch zijn. Bijvoorbeeld, het HIV genoom (figuur \(\Paginindex{6}\)) heeft verschillende genen die elkaar overlappen.
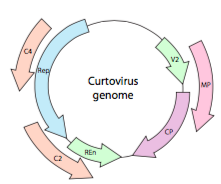
of, in het geval van curtovirussen, ssdna-plantenvirussen (bijvoorbeeld bietkrullend topvirus), het genoom heeft niet alleen over-Rep lappen genen, het is zelfs bi-directioneel (figuur \(\Paginindex{7}\)) coderen genproducten in beide strengen DNA nadat de ssDNA is omgezet in dsDNA.
gezien de behoefte aan Economie, welke genen worden er in virussen gevonden? Een van de meest bestudeerde virale genoom, bacteriofaag λ, bevat genen die coderen van vijf transcriptionele controle eiwitten (die worden uitgedrukt, is afhankelijk van de vraag of de faag is in een lysogenic of dodelijke modus), een bindend eiwit dat de controles van de afbraak van een transcriptionele activator, 17 capside-eiwitten, een excisionase dat de controles van de besnijdenis en het inbrengen van de faag genoom in het gastheer genoom, een integratie eiwit dat voegt de faag genoom in de gastheer, en 3 genen die deelnemen in lysis van de ontvangende cel.
het hierboven afgebeelde HIV-genoom is veel kleiner dan λ, met ongeveer 9 kilobasen vergeleken met 48 kb, maar nogmaals, het thema is om cellulaire eiwitten te gebruiken waar mogelijk, en zo nodig virale genen te coderen. Dus, gag codeert capside eiwitten, pol codeert reverse transcriptase, integrase, en HIV protease( die de gag en pol gen producten splitst in hun functionele eiwitten), vif werkt tegen een gemeenschappelijke gastheercel antivirale enzym, vpr regelt nucleaire import, Tat sterk verhoogt transcriptie van HIV genen, rev exporteert viraal RNA uit de kern, vpu is nodig voor het ontluiken van deeltjes uit de gastheer, env codeert virale envelop glycoproteïnen, en nef bevordert de overleving van geïnfecteerde cellen. De LTR-regio ‘ s zijn zeer sterke promotors om een hoge expressie van deze genen aan te drijven.
hoewel het niet lysogenie wordt genoemd, kunnen sommige dierlijke virussen zich op dezelfde manier gedragen. Het meest prominente voorbeeld is de klasse VI virussen van Baltimore-algemeen bekend als retroviruses, waarvan één HIV is. De weg van een retrovirus door een eukaryotic gastheercel wordt hieronder afgebeeld ( g. 5).
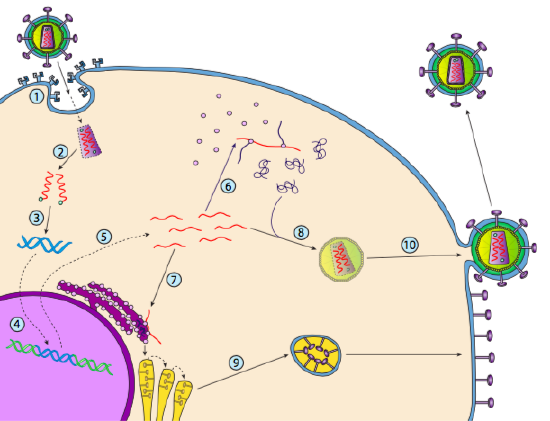
HIV heeft een omhulsel dat bezaaid is met transmembraaneiwitten die door de gastheercel worden herkend, waardoor het virus aan het celoppervlak wordt gebonden en receptorgemedieerde endocytose wordt geïnitieerd (1). Na de endocytose smelten de membraanenvelop van het virion en het vesiculaire membraan samen om de capside en de inhoud ervan vrij te geven (2). Nadat capside in het cytoplasma scheidt, worden de twee bundels van viraal RNA vrijgegeven samen met een speciale polymerase: omgekeerde transcriptase, die een malplaatje van RNA leest en DNA samenstelt. De omgekeerde transcriptase gebruikt ook dat nieuwe DNA om een bijkomende bundel van DNA samen te stellen zodat het uiteindelijk een dubbelstrengs versie van DNA van het virale genoom (3) produceert. Deze virale dsDNA wordt getransporteerd naar de kern waar het integraseert in het gastheergenoom met behulp van een ander viraal eiwit, integrase
(4). Het geà ntegreerde virale DNA wordt een provirus genoemd. Het provirus kan slapend liggen, maar als het wordt geactiveerd, dan wordt het getranscribeerd en het resulterende virale RNA wordt uit de kern getransporteerd (5). Sommige virale RNA codeert enzymen zoals reverse transcriptase en integrase, of capside eiwitten, die allemaal worden gemaakt in het cytoplasma (6), maar sommige coderen membraan gebonden glycoproteïnen, die worden getransloceerd in de ER (7) en uiteindelijk verwerkt door de Golgi en opgenomen in het plasmamembraan (9). Zodra het virion is samengesteld (8), bindt het aan de virale transmembraanproteã nen, die een exocytic “blaasje” (10) nucleating nucleating is die het virion compleet met virale envelop is.
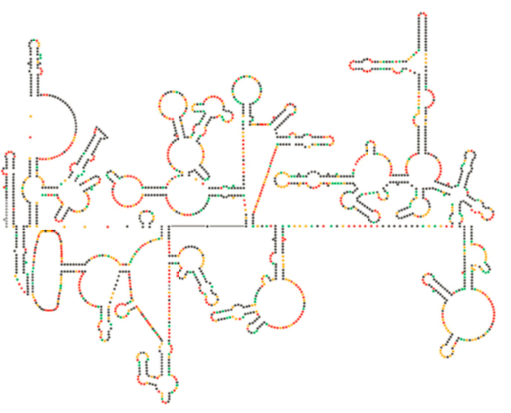
Recent structureel onderzoek van het HIV-genoom suggereert dat de structuur van HIV-RNA zelf een belangrijke rol kan spelen bij de voortplanting in gastheercellen. Figuur \(\Paginindex{8}\), van Watts et al, Nature 460:711-716, 2009, toont een voorspelde secundaire structuur van het genoom. De auteurs stellen voor dat de structuur van RNA eigenlijk met ribosomale verlenging kan in wisselwerking staan om het vouwen van de virale proteã nen te controleren. Zij postuleren ook de uitbreiding van dit argument om belangrijke genetische informatie te omvatten die niet alleen in de nucleotideopeenvolging, maar de secundaire structuur en tertiaire structuur van om het even welk virus van RNA wordt gecodeerd.
bij het overwegen van virussen met betrekking tot de rest van dit integratieve hoofdstuk, zijn er twee overheersende ideeën om in gedachten te houden. Ten eerste, virale overleving is gebaseerd op aantallen: het moet enorme aantallen van zijn componenten maken om zo breed mogelijk een net voor nieuwe gastheercellen te werpen. Om dit te doen, zijn de virale promotors gewoonlijk veel sterker dan de promotors van de gastheercel, die tegelijkertijd meer virale genuitdrukking drijven terwijl het verhinderen gastheergenuitdrukking (door cellulaire middelen aan virusproductie te wijden). Ten tweede, wegens snelle generatietijden, is het tarief van virale verandering en evolutie veel sneller dan normale eukaryotic genomen. Bovendien, als het virus zijn eigen polymerase gebruikt (zoals reverse transcriptase of RNA Replica), stijgt de mutatiesnelheid nog meer omdat er geen foutcontrole door virale polymerasen is.