16.2: Cycles de vie Viraux
La Voie lysogène
Une meilleure option pour certains virus bactériens est appelée voie lysogène. Les bactériophages qui ont cette option, ainsi qu’une voie lytique, sont connus sous le nom de phage tempéré. Dans cette voie, le virus entre en dormance en s’intégrant dans le génome de l’hôte et en restant au repos transcriptionnel jusqu’à ce que les conditions environnementales changent et reflètent une probabilité que davantage de cellules hôtes infectent (Figure \(\PageIndex{4}\)).
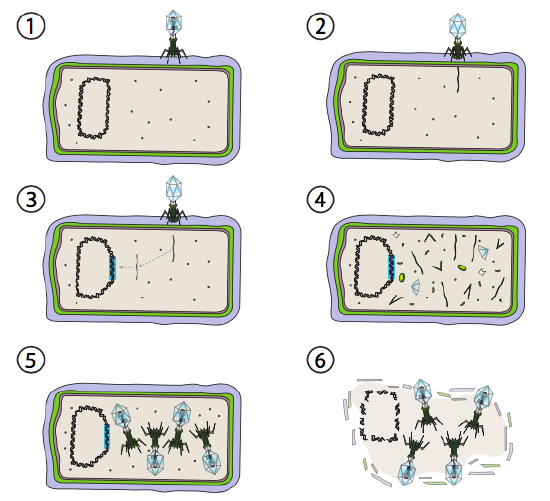
Lambda(λ) est un exemple de bactériophage tempéré. Les étapes initiales de l’infection et de l’injection du génome sont les mêmes que le cycle lytique, mais dans des conditions favorisant la lysogénie, le génome viral est intégré dans le génome hôte à l’étape 3. En λ intégration dans E. coli, cela se produit par recombinaison réciproque au niveau d’une séquence de paires de 15 bases connue sous le nom de site att λ et est facilitée par le produit du gène Int. Tant que les conditions environnementales ne sont pas propices à la reproduction bactérienne (et donc au nombre limité de cellules hôtes possibles), le génome viral reste principalement caché et inactif. La seule exception significative est un gène codant pour un répresseur λ qui empêche l’étape suivante et maintient le virus en sommeil.
Cette étape suivante est l’excision de l’ADN phage λ du chromosome hôte, puis la réplication et la transcription de l’ADN viral (Figure \(\PageIndex{4}\), Étape 4). Ensuite, comme précédemment, les dernières étapes sont l’assemblage et l’accumulation de virions, et la dégradation éventuelle de la structure cellulaire et la libération des particules virales.
Pour pouvoir être empaquetés dans les contraintes d’espace restreintes offertes par les capsides, les génomes viraux doivent être très économiques. Par exemple, le génome du VIH (Figure \(\PageIndex{6}\)) a plusieurs gènes qui se chevauchent.
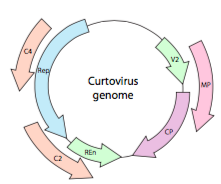
Ou, dans le cas des curtovirus, des virus de la plante à adNSS (par exemple, le virus de la betterave frisée), le génome ne contient pas seulement des gènes de rodage sur-Rep, il est même bidirectionnel (Figure\(\PageIndex{7}\)) codant des produits géniques dans les deux brins d’ADN après la conversion de l’adNSS en adNSS.
Compte tenu du besoin d’économie, quels gènes se trouvent dans les virus? L’un des génomes viraux les plus étudiés, le bactériophage λ, contient des gènes codant pour cinq protéines de contrôle transcriptionnel (lesquelles sont exprimées selon que le phage est en mode lysogène ou lytique), une protéine de liaison qui contrôle la dégradation d’un activateur transcriptionnel, 17 protéines de capside, une excisionase qui contrôle l’excision et l’insertion du génome du phage dans le génome de l’hôte, une protéine d’intégration qui insère le génome du phage dans celui de l’hôte, et 3 gènes participant à la lyse de la cellule hôte.
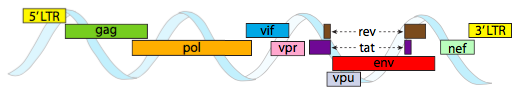
Le génome du VIH décrit ci-dessus est beaucoup plus petit que λ, à environ 9 kilobases contre 48 kb, mais là encore, le thème est d’utiliser des protéines cellulaires lorsque cela est possible, et de coder des gènes viraux si nécessaire. Ainsi, gag code les protéines de la capside, pol code la transcriptase inverse, l’intégrase et la protéase du VIH (qui clive les produits des gènes gag et pol en leurs protéines fonctionnelles), vif agit contre une enzyme antivirale commune de la cellule hôte, vpr régule l’importation nucléaire, tat augmente fortement la transcription des gènes du VIH, rev exporte l’ARN viral du noyau, vpu est nécessaire au bourgeonnement des particules de l’hôte, env code les glycoprotéines de l’enveloppe virale et nef favorise la survie des cellules infectées. Les régions LTR sont de très puissants promoteurs pour stimuler une expression élevée de ces gènes.
Bien qu’il ne soit pas appelé lysogénie, certains virus animaux peuvent se comporter de la même manière. L’exemple le plus frappant est celui des virus de classe VI de Baltimore, communément appelés rétrovirus, dont l’un est le VIH. Le trajet d’un rétrovirus à travers une cellule hôte eucaryote est décrit ci-dessous (g. 5).
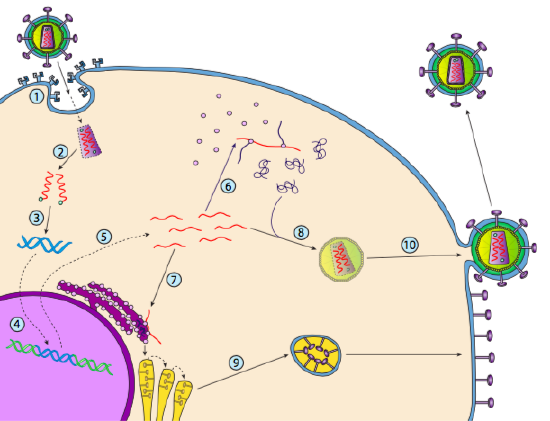
Le VIH a une enveloppe, qui est parsemée de protéines transmembranaires reconnues par la cellule hôte, liant le virus à la surface de la cellule et initiant une endocytose médiée par les récepteurs (1). Après l’endocytose, l’enveloppe membranaire du virion et la membrane vésiculaire fusionnent pour libérer la capside et son contenu (2). Une fois la capside dissociée dans le cytoplasme, les deux brins d’ARN viral sont libérés avec une polymérase spéciale: la transcriptase inverse, qui lit un modèle d’ARN et synthétise l’ADN. La transcriptase inverse utilise également ce nouvel ADN pour synthétiser un brin d’ADN complémentaire afin de produire éventuellement une version d’ADN double brin du génome viral (3). Cet ADND viral est transporté dans le noyau où il s’intègre dans le génome de l’hôte à l’aide d’une autre protéine virale, l’intégrase
(4). L’ADN viral intégré est appelé provirus. Le provirus peut rester en sommeil, mais s’il est activé, il est transcrit et l’ARN viral résultant est transporté hors du noyau (5). Une partie de l’ARN viral code pour des enzymes comme la transcriptase inverse et l’intégrase, ou des protéines de capside, qui sont toutes fabriquées dans le cytoplasme (6), mais certaines codent pour des glycoprotéines liées à la membrane, qui sont translocées dans l’ER (7) et éventuellement traitées par le Golgi et incorporées dans la membrane plasmique (9). Une fois le virion assemblé (8), il se lie aux protéines transmembranaires virales, nucléant une « vésicule » exocytaire (10) qui est le virion complet avec enveloppe virale.
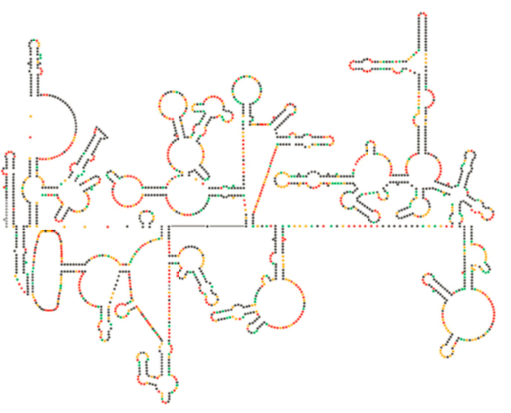
Un examen structurel récent du génome du VIH suggère que la structure de l’ARN du VIH lui-même pourrait jouer un rôle important dans sa propagation à l’intérieur des cellules hôtes. La figure \(\PageIndex{8}\), tirée de Watts et al, Nature 460:711-716, 2009, montre une structure secondaire prévue du génome. Les auteurs suggèrent que la structure de l’ARN peut en fait interagir avec l’allongement ribosomique pour contrôler le repliement des protéines virales. Ils postulent également l’extension de cet argument pour inclure des informations génétiques importantes codées non seulement dans la séquence nucléotidique, mais la structure secondaire et la structure tertiaire de tout virus à ARN.
En considérant les virus par rapport au reste de ce chapitre intégratif, il y a deux idées primordiales à garder à l’esprit. Tout d’abord, la survie virale est basée sur les nombres: il doit fabriquer un grand nombre de ses composants pour jeter un filet aussi large que possible pour de nouvelles cellules hôtes. Pour ce faire, les promoteurs viraux sont généralement beaucoup plus puissants que les promoteurs de cellules hôtes, entraînant simultanément plus d’expression génique virale tout en empêchant l’expression génique de l’hôte (en consacrant des ressources cellulaires à la production de virus). Deuxièmement, en raison des temps de génération rapides, le taux de mutation virale et d’évolution est beaucoup plus rapide que les génomes eucaryotes normaux. De plus, si le virus utilise sa propre polymérase (telle que la transcriptase inverse ou l’ARN réplicase), le taux de mutation augmente encore plus car il n’y a pas de vérification d’erreur par les polymérases virales.