16.2: Virale Lebenszyklen
Der lysogene Weg
Eine bessere Option für einige bakterielle Viren ist der lysogene Weg. Die Bakteriophagen, die diese Option haben, sowie ein lytischer Weg, sind als gemäßigter Phage bekannt. Auf diesem Weg geht das Virus in den Ruhezustand, indem es sich in das Wirtsgenom integriert und transkriptionell ruhig bleibt, bis sich die Umweltbedingungen ändern und die Wahrscheinlichkeit einer Infektion mit mehr Wirtszellen widerspiegeln (Abbildung \(\pageIndex{4}\)).
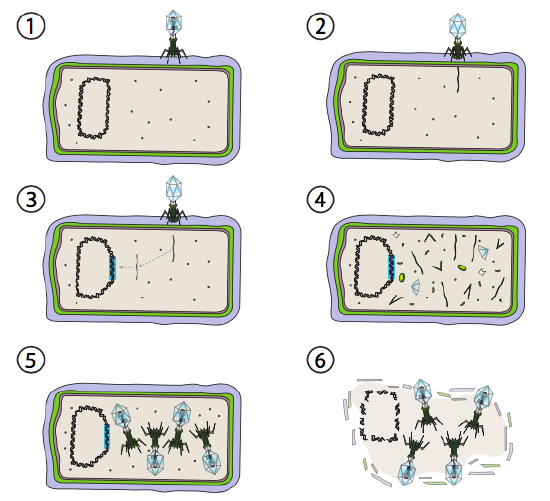
Lambda (λ) ist ein Beispiel für einen gemäßigten Bakteriophagen. Die Anfangsstadien der Infektion und der Genominjektion sind die gleichen wie beim lytischen Zyklus, aber unter Bedingungen, die die Lysogenese fördern, wird das virale Genom in Schritt 3 in das Wirtsgenom integriert. Bei der Integration in E. dies geschieht jedoch durch reziproke Rekombination an einer 15-Basenpaarsequenz, die als att λ-Stelle bekannt ist, und wird durch das Int-Genprodukt erleichtert. Solange die Umweltbedingungen der bakteriellen Vermehrung nicht förderlich sind (und damit eine begrenzte Anzahl möglicher Wirtszellen), bleibt das virale Genom meist verborgen und inaktiv. Die einzige signifikante Ausnahme ist ein Gen, das für einen λ-Repressor kodiert, der den nächsten Schritt verhindert und das Virus inaktiv hält.
Der nächste Schritt ist die Exzision der λ-Phagen-DNA aus dem Wirtschromosom und die anschließende Replikation und Transkription der viralen DNA (Abbildung \(\pageIndex{4}\), Schritt 4). Dann, wie zuvor, sind die letzten Schritte die Montage und Akkumulation von Virionen und schließlich der Abbau der Zellstruktur und die Freisetzung der Viruspartikel.
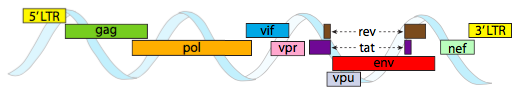
Um in die engen Platzverhältnisse von Kapsiden zu verpacken, müssen virale Genome sehr wirtschaftlich sein. Zum Beispiel hat das HIV-Genom (Abbildung \(\pageIndex{6}\)) mehrere Gene, die sich überlappen.
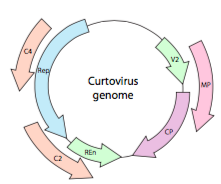
Oder, im Falle von Curtoviren, ssDNA-Pflanzenviren (z.B. Beet curly Top Virus), das Genom hat nicht nur Over-Rep-Lapping-Gene, es ist sogar bidirektional (Abbildung \(\pageIndex{7}\)) und kodiert Genprodukte in beiden DNA-Strängen, nachdem die ssDNA in dsDNA umgewandelt wurde.
Welche Gene finden sich angesichts der Notwendigkeit der Ökonomie in Viren? Eines der am meisten untersuchten viralen Genome, Bakteriophagen λ, enthält Gene, die fünf Transkriptionskontrollproteine kodieren (welche exprimiert werden, hängt davon ab, ob sich der Phage in einem lysogenen oder lytischen Modus befindet), ein Bindungsprotein, das den Abbau eines Transkriptionsaktivators steuert, 17 Kapsidproteine, eine Exzisionase, die die Exzision und Insertion des Phagengenoms in das Wirtsgenom steuert, ein Integrationsprotein, das das Phagengenom in das Wirtsgenom einfügt, und 3 Gene, die an der Lyse der Wirtszelle beteiligt sind.
Das oben abgebildete HIV-Genom ist mit etwa 9 Kilobasen im Vergleich zu 48 kb viel kleiner als λ, aber auch hier geht es darum, nach Möglichkeit zelluläre Proteine zu verwenden und bei Bedarf virale Gene zu kodieren. So codiert gag Kapsidproteine, Pol codiert Reverse Transkriptase, Integrase und HIV-Protease (die die Gag- und Pol-Genprodukte in ihre funktionellen Proteine spaltet), vif wirkt gegen ein gemeinsames antivirales Enzym der Wirtszelle, vpr reguliert den Nuklearimport, tat erhöht die Transkription von HIV-Genen stark, rev exportiert virale RNA aus dem Zellkern, vpu wird für die Knospung von Partikeln aus dem Wirt benötigt, env codiert virale Hüllglykoproteine und nef fördert das Überleben infizierter Zellen. Die LTR-Regionen sind sehr starke Promotoren für eine hohe Expression dieser Gene.
Obwohl es nicht als Lysogenie bezeichnet wird, können sich einige Tierviren ähnlich verhalten. Das prominenteste Beispiel sind die Baltimore-Klasse-VI-Viren – allgemein bekannt als Retroviren, von denen eines HIV ist. Der Weg eines Retrovirus durch eine eukaryotische Wirtszelle ist unten dargestellt ( g. 5).
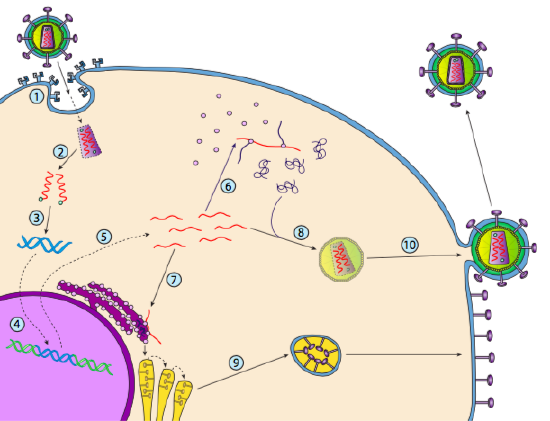
HIV hat eine Hülle, die mit Transmembranproteinen besetzt ist, die von der Wirtszelle erkannt werden, das Virus an die Zelloberfläche binden und eine rezeptorvermittelte Endozytose auslösen (1). Nach der Endozytose verschmelzen die Membranhülle des Virions und die Vesikelmembran, um das Kapsid und seinen Inhalt freizusetzen (2). Nachdem das Kapsid im Zytoplasma dissoziiert ist, werden die beiden Stränge der viralen RNA zusammen mit einer speziellen Polymerase freigesetzt: der reversen Transkriptase, die eine RNA-Schablone liest und DNA synthetisiert. Reverse Transkriptase verwendet diese neue DNA auch, um einen komplementären DNA-Strang zu synthetisieren, so dass schließlich eine doppelsträngige DNA-Version des viralen Genoms erzeugt wird (3). Diese virale dsDNA wird in den Zellkern transportiert, wo sie sich unter Verwendung eines anderen viralen Proteins, der Integrase
(4), in das Wirtsgenom integriert. Die integrierte virale DNA wird als Provirus bezeichnet. Das Provirus kann ruhend liegen, aber wenn es aktiviert wird, wird es transkribiert und die resultierende virale RNA wird aus dem Kern transportiert (5). Ein Teil der viralen RNA kodiert Enzyme wie reverse Transkriptase und Integrase oder Kapsidproteine, die alle im Zytoplasma hergestellt werden (6), aber einige kodieren membrangebundene Glykoproteine, die in den ER transloziert werden (7) und schließlich durch den Golgi verarbeitet und in die Plasmamembran eingebaut (9). Sobald das Virion zusammengebaut wurde (8), bindet es an die viralen Transmembranproteine und bildet ein exozytisches „Vesikel“ (10), das das Virion mit viraler Hülle ist.
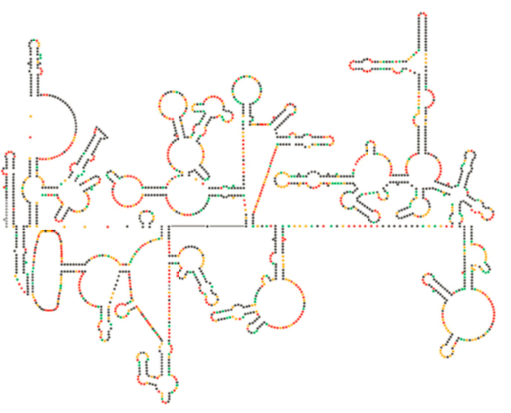
Neuere strukturelle Untersuchungen des HIV-Genoms legen nahe, dass die Struktur der HIV-RNA selbst eine bedeutende Rolle bei ihrer Vermehrung innerhalb von Wirtszellen spielen könnte. Abbildung\(\pageIndex{8}\), von Watts et al, Nature 460:711-716, 2009, zeigt eine vorhergesagte Sekundärstruktur des Genoms. Die Autoren schlagen vor, dass die RNA-Struktur tatsächlich mit der ribosomalen Dehnung interagieren kann, um die Faltung der viralen Proteine zu kontrollieren. Sie postulieren auch die Erweiterung dieses Arguments auf wichtige genetische Informationen, die nicht nur in der Nukleotidsequenz, sondern auch in der Sekundär- und Tertiärstruktur eines RNA-Virus kodiert sind.
Bei der Betrachtung von Viren in Bezug auf den Rest dieses integrativen Kapitels sind zwei übergeordnete Ideen zu beachten. Erstens basiert das virale Überleben auf Zahlen: Es muss eine große Anzahl seiner Komponenten herstellen, um ein möglichst breites Netz für neue Wirtszellen zu bilden. Um dies zu erreichen, sind virale Promotoren normalerweise viel stärker als Wirtszell-Promotoren und treiben gleichzeitig mehr virale Genexpression an, während sie die Wirtsgenexpression verhindern (indem sie zelluläre Ressourcen der Virusproduktion widmen). Zweitens ist die Rate der viralen Mutation und Evolution aufgrund der schnellen Generationszeiten weitaus schneller als bei normalen eukaryotischen Genomen. Wenn das Virus außerdem eine eigene Polymerase (wie reverse Transkriptase oder RNA-Replikase) verwendet, steigt die Mutationsrate noch weiter an, da keine Fehlerprüfung durch virale Polymerasen erfolgt.