16.2: virale livscyklusser
den lysogene vej
en bedre mulighed for nogle bakterielle vira kaldes den lysogene vej. Bakteriofagen, der har denne mulighed, såvel som en lytisk vej, er kendt som tempereret fag. I denne vej går virussen i dvale ved at integrere sig i værtsgenomet og forblive transkriptionelt hvilende, indtil miljøforholdene ændres og afspejler sandsynligheden for, at flere værtsceller inficerer (figur \(\Sideindeks{4}\)).
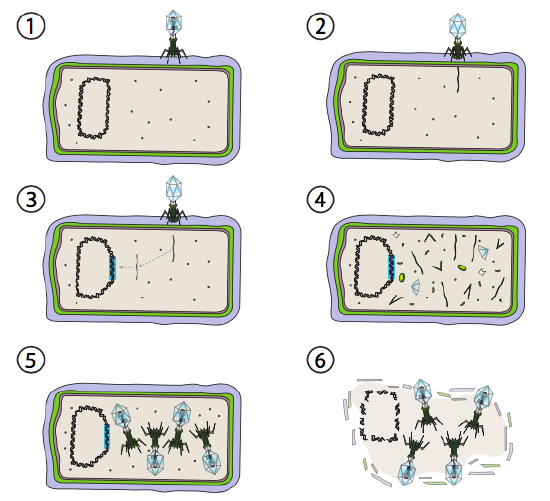
Lambda (Kurt) er et eksempel på en tempereret bakteriofag. De indledende stadier af infektion og genominjektion er de samme som den lytiske cyklus, men under betingelser, der tilskynder lysogeni, integreres det virale genom i værtsgenomet i trin 3. I Kristus integration i E. coli, dette sker ved gensidig rekombination ved en 15-basepar-sekvens kendt som att-LARP-stedet og lettes af Int-genproduktet. Så længe miljøforholdene ikke er befordrende for bakteriel reproduktion (og dermed begrænset antal mulige værtsceller), forbliver det virale genom for det meste skjult og inaktivt. Den eneste væsentlige undtagelse er et gen, der koder for en purpur-repressor, der forhindrer det næste trin og holder virussen i dvale.
det næste trin er udskæringen af DNA ‘ et fra værtsromosomet og efterfølgende replikation og transkription af det virale DNA (figur \(\Sideindeks{4}\), trin 4). Derefter, som før, er de sidste trin samling og ophobning af virioner og eventuel nedbrydning af cellulær struktur og frigivelse af de virale partikler.
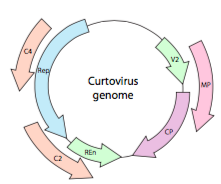
for at pakke ind i de stramme pladsbegrænsninger, der ydes af capsider, skal virale genomer være meget økonomiske. For eksempel har HIV-genomet (figur \(\Sideindeks{6}\)) flere gener, der overlapper hinanden.
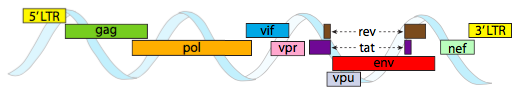
eller, i tilfælde af curtovirus, ssdna – plantevirus (f.eks.
i betragtning af behovet for økonomi, hvilke gener findes der i Vira? Et af de mest undersøgte virale genomer, bakteriofag, indeholder gener, der koder for fem transkriptionelle kontrolproteiner (hvilke udtrykkes afhænger af, om faggen er i en lysogen eller lytisk tilstand), et bindende protein, der styrer nedbrydning af en transkriptionsaktivator, 17 kapsidproteiner, en ekscisionase, der styrer udskæring og indsættelse af faggenomet i værtsgenomet, et integrationsprotein, der indsætter faggenomet i værtens og 3 gener, der deltager i lysis af værtscellen.
HIV-genomet, der er afbildet ovenfor, er meget mindre end karrus, omkring 9 kilobaser sammenlignet med 48 kb, men igen er temaet at bruge cellulære proteiner, når det er muligt, og om nødvendigt kode virale gener. Så gag koder for kapsidproteiner, pol koder for revers transkriptase, integrase og HIV-protease (som spalter gag-og pol-genprodukterne i deres funktionelle proteiner), Vif virker mod et fælles værtscelleantiviralt middel, VPR regulerer nuklear import, tat øger kraftigt transkription af HIV-gener, rev eksporterer viralt RNA fra kernen, vpu er nødvendig til spirende partikler fra værten, env koder for virale konvolutglycoproteiner, og nef fremmer overlevelse af inficerede celler. Ltr-regionerne er meget stærke promotorer til at drive høj ekspression af disse gener.
selvom det ikke kaldes lysogeni, kan nogle dyrevirus opføre sig på samme måde. Det mest fremtrædende eksempel er Baltimore klasse VI – vira-almindeligvis kendt som retrovirus, hvoraf den ene er HIV. Stien til et retrovirus gennem en eukaryot værtscelle er afbildet nedenfor (g. 5).
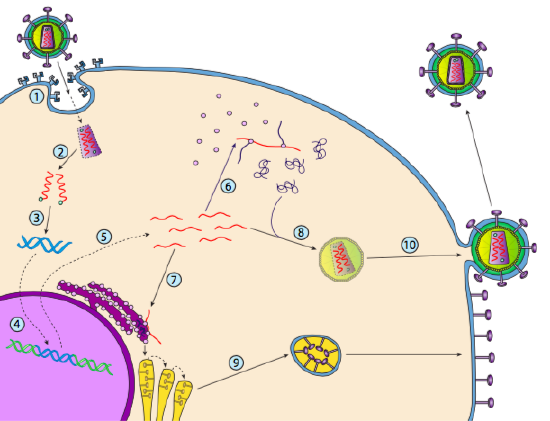
HIV har en konvolut, der er besat med transmembranproteiner, der genkendes af værtscellen, binder virussen til celleoverfladen og initierer receptormedieret endocytose (1). Efter endocytosen smelter membranhylsteret af virionen og den vesikulære membran for at frigive kapsidet og dets indhold (2). Efter at kapsidet er dissocieret i cytoplasmaet, frigives de to tråde af viralt RNA sammen med en speciel polymerase: revers transkriptase, som læser en RNA-skabelon og syntetiserer DNA. Omvendt transkriptase bruger også det nye DNA til at syntetisere en komplementær DNA – streng, så den til sidst producerer en dobbeltstrenget DNA-version af det virale genom (3). Dette virale dsDNA transporteres ind i kernen, hvor det integreres i værtsgenomet ved hjælp af et andet viralt protein, integrase
(4). Det integrerede virale DNA kaldes et provirus. Proviruset kan ligge i dvale, men hvis det aktiveres, transkriberes det, og det resulterende virale RNA transporteres ud af kernen (5). Nogle af de virale RNA koder for revers transkriptase og integrase eller kapsidproteiner, som alle er fremstillet i cytoplasmaet (6), men nogle koder membranbundne glycoproteiner, som translokeres til ER (7) og til sidst behandles gennem Golgi og inkorporeres i plasmamembranen (9). Når virionen er samlet (8), binder den sig til de virale transmembranproteiner og danner en eksocytisk “vesikel” (10), som er virionen komplet med viral konvolut.
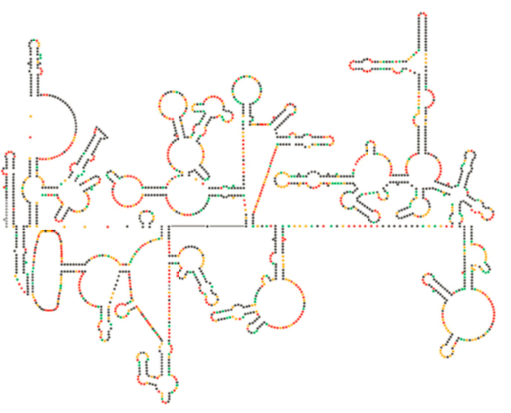
nylig strukturel undersøgelse af HIV-genomet antyder, at strukturen af HIV-RNA i sig selv kan spille en væsentlig rolle i dens udbredelse inde i værtsceller. Figur \(\Sideindeks{8}\), Fra Natur 460:711-716, 2009, viser en forudsagt sekundær struktur af genomet. Forfatterne antyder, at RNA-strukturen faktisk kan interagere med ribosomal forlængelse for at kontrollere foldningen af de virale proteiner. De postulerer også udvidelsen af dette argument til at omfatte vigtig genetisk information kodet ikke kun i nukleotidsekvensen, men den sekundære struktur og tertiære struktur af enhver RNA-virus.
Ved overvejelse af vira med hensyn til resten af dette integrerende kapitel er der to overordnede ideer at huske på. For det første er viral overlevelse baseret på tal: det skal gøre et stort antal af dets komponenter til at kaste så bredt et net til nye værtsceller som muligt. For at gøre dette er virale promotorer normalt meget stærkere end værtscellepromotorer, samtidig med at de driver mere viral genekspression, mens de forhindrer værtsgenekspression (ved at dedikere cellulære ressourcer til virusproduktion). For det andet er hastigheden af viral mutation og evolution På grund af hurtige generationstider langt hurtigere end normale eukaryote genomer. Derudover, hvis virussen bruger sin egen polymerase (såsom revers transkriptase eller RNA-replikase), stiger mutationshastigheden endnu mere, fordi der ikke er nogen fejlkontrol af virale polymeraser.