16.2: virala livscykler
den lysogena vägen
ett bättre alternativ för vissa bakterievirus kallas den lysogena vägen. Bakteriofagen som har detta alternativ, liksom en lytisk väg, är känd som tempererad FAG. I denna väg går viruset i viloläge genom att integreras i värdgenomet och förblir transkriptionellt vilande tills miljöförhållandena förändras och återspeglar en sannolikhet för att fler värdceller ska infektera (figur \(\PageIndex{4}\)).
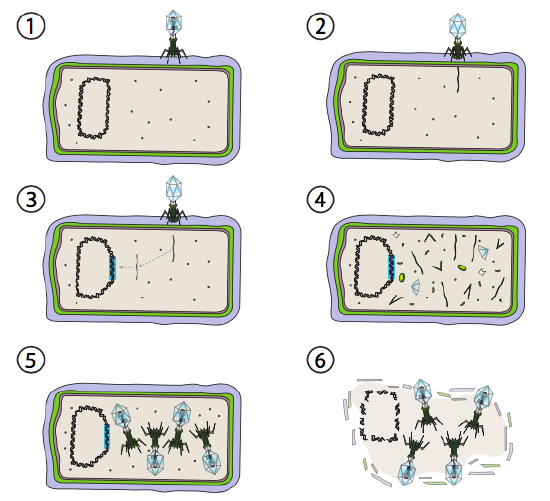
Lambda (XHamster) är ett exempel på en tempererad bakteriofag. De initiala stadierna av infektion och genominjektion är desamma som den lytiska cykeln, men under förhållanden som uppmuntrar lysogeni integreras virusgenomet i värdgenomet i steg 3. I augusti integration i E. coli, detta sker genom ömsesidig rekombination vid en 15-basparsekvens känd som att-platsen för att och underlättas av Int-genprodukten. Så länge miljöförhållandena inte bidrar till bakteriell reproduktion (och därmed begränsat antal möjliga värdceller) förblir virusgenomet mestadels dolt och inaktivt. Det enda signifikanta undantaget är en gen som kodar för en nigeriansk repressor som förhindrar nästa steg och håller viruset vilande.
det nästa steget är excisionen av fag-DNA från värdkromosomen och efterföljande replikering och transkription av viralt DNA (figur \(\PageIndex{4}\), steg 4). Sedan, som tidigare, är de sista stegen montering och ackumulering av virioner och eventuell nedbrytning av cellulär struktur och frisättning av viruspartiklarna.
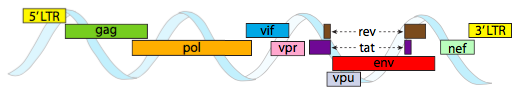
för att förpackas i de trånga utrymmesbegränsningar som capsids ger, måste virala Genom vara mycket ekonomiska. Till exempel har HIV-genomet (figur \(\PageIndex{6}\)) flera gener som överlappar varandra.
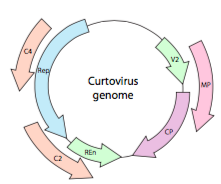
eller, när det gäller curtovirus, ssDNA – växtvirus (t.ex. beet curly top-virus), har genomet inte bara överrepande gener, det är till och med dubbelriktad (figur \(\PageIndex{7}\)) som kodar för genprodukter i båda DNA-strängarna efter att ssDNA har omvandlats till dsDNA.
Med tanke på behovet av ekonomi, vilka gener finns i virus? Ett av de mest studerade virala genomerna, bacteriophage bisexual, innehåller gener som kodar för fem transkriptionskontrollproteiner (vilka uttrycks beror på om Fagen är i lysogen eller lytisk läge), ett bindande protein som styr nedbrytning av en transkriptionsaktivator, 17 kapsidproteiner, ett excisionas som styr excision och införande av faggenomet i värdgenomet, ett integrationsprotein som sätter in faggenomet i värdens och 3 gener som deltar i lys av värdcellen.
HIV-genomet som avbildas ovan är mycket mindre än 0 kg, vid cirka 9 kilobaser jämfört med 48 kb, men återigen är temat att använda cellulära proteiner när det är möjligt och koda virusgener om det behövs. Så, gag kodar kapsidproteiner, pol kodar omvänd transkriptas, integrase och HIV-proteas (som klyver gag-och pol-genprodukterna i sina funktionella proteiner), Vif verkar mot ett gemensamt värdcell antiviralt enzym, VPR reglerar kärnimport, tat ökar starkt transkriptionen av HIV-gener, rev exporterar viralt RNA från kärnan, vpu behövs för spirande av partiklar från värden, env kodar virushölje glykoproteiner, och nef främjar överlevnad av infekterade celler. LTR-regionerna är mycket starka promotorer för att driva högt uttryck av dessa gener.
även om det inte kallas lysogeni, kan vissa djurvirus uppträda på samma sätt. Det mest framträdande exemplet är Baltimore klass VI-virus-allmänt känt som Retrovirus, varav ett är HIV. Vägen för ett retrovirus genom en eukaryot värdcell visas nedan (g. 5).
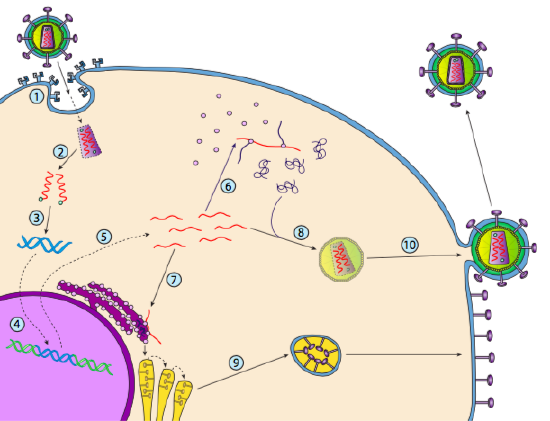
HIV har ett kuvert, som är besatt med transmembranproteiner som känns igen av värdcellen, binder viruset till cellytan och initierar receptormedierad endocytos (1). Efter endocytosen smälter membranhöljet på virionen och det vesikulära membranet för att frigöra kapsiden och dess innehåll (2). Efter att kapsiden dissocierats i cytoplasman frigörs de två strängarna av viralt RNA tillsammans med ett speciellt polymeras: omvänd transkriptas, som läser en RNA-Mall och syntetiserar DNA. Omvänt transkriptas använder också det nya DNA för att syntetisera en komplementär DNA-sträng så att den så småningom producerar en dubbelsträngad DNA – version av virusgenomet (3). Denna virala dsDNA transporteras in i kärnan där den integreras i värdgenomet med ett annat viralt protein, integrase
(4). Det integrerade virala DNA kallas ett provirus. Proviruset kan ligga vilande, men om det aktiveras transkriberas det och det resulterande virala RNA transporteras ut ur kärnan (5). En del av det virala RNA kodar enzymer som omvänt transkriptas och Integras, eller kapsidproteiner, som alla tillverkas i cytoplasman (6), men vissa kodar membranbundna glykoproteiner, som translokeras till ER (7) och så småningom bearbetas genom Golgi och införlivas i plasmamembranet (9). När virionen har monterats (8), binder den till de virala transmembranproteinerna, kärnbildande en exocytisk ”vesikel” (10) som är virionen komplett med viralt kuvert.
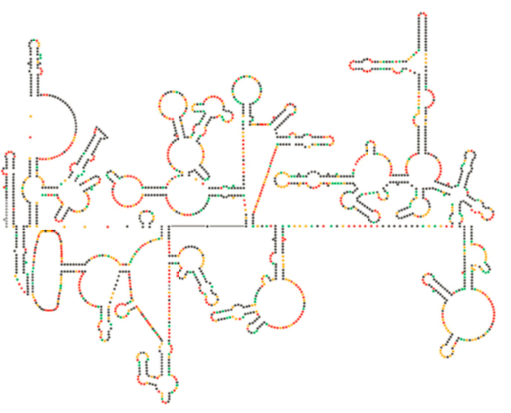
nyligen strukturell undersökning av HIV-genomet antyder att strukturen av HIV-RNA i sig kan spela en viktig roll i dess förökning inuti värdceller. Figur \(\PageIndex{8}\), Från Watts et al, Nature 460:711-716, 2009, visar en förutsagd sekundär struktur av genomet. Författarna föreslår att RNA-strukturen faktiskt kan interagera med ribosomal töjning för att kontrollera vikningen av virusproteinerna. De postulerar också utvidgningen av detta argument för att inkludera viktig genetisk information kodad inte bara i nukleotidsekvensen utan den sekundära strukturen och tertiära strukturen hos vilket RNA-virus som helst.
När man överväger virus med avseende på resten av detta integrerade kapitel finns det två övergripande ideer att tänka på. För det första är viral överlevnad baserad på siffror: det måste göra ett stort antal av dess komponenter för att kasta så stort nät för nya värdceller som möjligt. För att göra detta är virala promotorer vanligtvis mycket starkare än värdcellpromotorer, samtidigt som de driver mer viralt genuttryck samtidigt som de förhindrar värdgenuttryck (genom att ägna cellulära resurser till virusproduktion). För det andra, på grund av snabba generationstider, är graden av viral mutation och evolution mycket snabbare än normala eukaryota genom. Dessutom, om viruset använder sitt eget polymeras (såsom omvänt transkriptas eller RNA-replik), stiger mutationshastigheten ännu mer eftersom det inte finns någon felkontroll av virala polymeraser.