16.2: Virové Životní Cykly
Lysogenic Dráhy
lepší volba pro některé bakteriální viry se nazývá lysogenic dráhy. Bakteriofág, který má tuto možnost, stejně jako lytická dráha, jsou známé jako mírný fág. V této dráze, virus přejde do vegetačního klidu integrací do hostitelského genomu, a zbývající transkripčně klidu, dokud se podmínky prostředí mění a odrážejí pravděpodobnost více hostitelských buněk infikovat (Obrázek \(\PageIndex{4}\)).
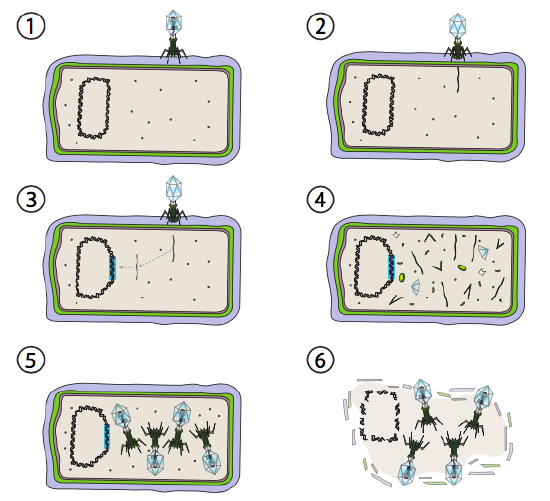
Lambda (λ) je příklad mírného bakteriofága. Počáteční fáze infekce a genomu injekce jsou stejné jako lytický cyklus, ale za podmínek, které podporují lysogeny, virový genom začleněn do hostitelského genomu v kroku 3. V λ integraci do e. coli, k tomu dochází reciproční rekombinací v sekvenci párů 15 bází známé jako místo att λ a je usnadněno produktem genu Int. Pokud podmínky prostředí nepřispívají k bakteriální reprodukci (a tedy omezenému počtu možných hostitelských buněk), virový genom zůstává většinou skrytý a neaktivní. Jedinou významnou výjimkou je gen kódující λ represor, který zabraňuje dalšímu kroku a udržuje virus spící.
dalším krokem je vyříznutí λ fágové DNA z chromozomu hostitele a následné replikaci a transkripci virové DNA (Obrázek \(\PageIndex{4}\), Krok 4). Pak, stejně jako dříve, jsou konečnými kroky sestavení a akumulace virionů a případný rozpad buněčné struktury a uvolnění virových částic.
aby pro balení do těsných prostor omezení poskytované capsids, virových genomů musí být velmi úsporný. Například genom HIV (obrázek \(\PageIndex{6}\)) má několik genů, které se překrývají.
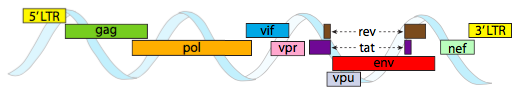
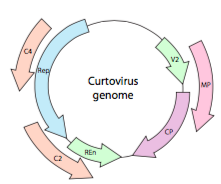
Nebo, v případě curtoviruses, ssDNA rostlinných virů (např. beet curly top virus), genom má nejen nad – Rep lapování geny, to je dokonce bi-directional (Obrázek \(\PageIndex{7}\)) kódující genové produkty v obou vláken DNA, po ssDNA byl převeden na dsDNA.
vzhledem k potřebě ekonomiky, jaké geny se nacházejí ve virech? Jedním z nejvíce studoval virové genomy, bakteriofág λ, obsahuje geny kódující pět transkripční kontrolu proteiny (ty, které jsou vyjádřeny, závisí na tom, zda fága je v lysogenic nebo lytické režim), vázající protein, který řídí degradaci transkripční aktivátor, 17 kapsidový proteiny, excisionase, že ovládací prvky, vyříznutí a vložení phage genomu do hostitelského genomu, integraci protein, který se vloží do genomu fága do hostitelské a 3 geny, účastnící se lýze hostitelské buňky.
HIV genom popsán výše, je mnohem menší než λ, kolem 9 kilobází, ve srovnání se 48 kb, ale znovu, téma je používat buněčné proteiny, když je to možné, a kódují virové geny, pokud je to nutné. Takže, gag kóduje kapsidový proteiny, pol kóduje reverzní transkriptázy, integrázy a HIV proteázy (který štěpí gag a pol genových produktů do jejich funkční proteiny), vif působí proti společné hostitelské buňky antivirové enzym, vpr reguluje jaderný import, tat silně zvyšuje transkripci HIV geny, rev vývoz virové RNA z jádra, vpu je potřeba pro začínající částic z hostitelské, env kóduje virové obálky glykoproteiny, a nef podporuje přežití infikovaných buněk. Oblasti LTR jsou velmi silnými promotory, které řídí vysokou expresi těchto genů.
ačkoli to není označováno jako lysogeny, některé zvířecí viry se mohou chovat podobně. Nejvýznamnějším příkladem jsou viry Baltimore třídy VI-běžně známé jako retroviry, jedním z nich je HIV. Cesta retroviru přes eukaryotickou hostitelskou buňku je znázorněna níže (g.5).
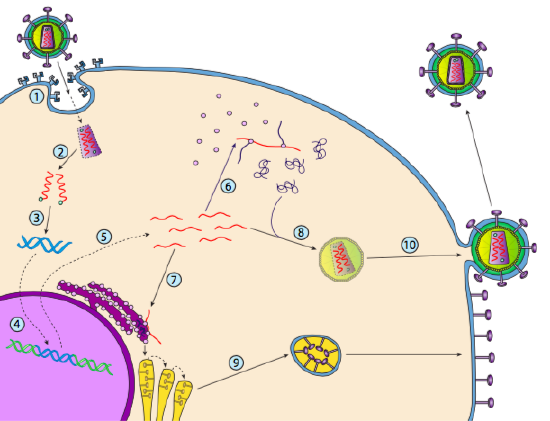
HIV má obálku, která je posetá s transmembránové proteiny, které jsou uznávány hostitelské buňky, vazba viru na povrchu buňky a zahájení receptory zprostředkovanou endocytózu (1). Po endocytóza, membránové obálky virion a vezikulární membrány pojistka k uvolnění kapsida a obsah (2). Po kapsidový odloučí v cytoplazmě, dva prameny virové RNA jsou uvolněny spolu se speciální polymerázy, reverzní transkriptázy, který čte RNA šablony a syntetizuje DNA. Reverzní transkriptáza také používá tuto novou DNA k syntéze komplementárního řetězce DNA, takže nakonec vytvoří dvouvláknovou DNA verzi virového genomu (3). Tato virová dsDNA je transportována do jádra, kde se integruje do hostitelského genomu pomocí jiného virového proteinu, integrázy
(4). Integrovaná virová DNA se nazývá provirus. Na provirus může ležel spící, ale když je aktivován, pak je přepsal a výsledný virové RNA je transportována z jádra (5). Některé virové RNA kóduje enzymy jako reverzní transkriptázy, integrázy a, nebo kapsidový proteinů, z nichž všechny jsou vyrobeny v cytoplazmě (6), ale některé kódují membránové glykoproteiny, které jsou přemístěný do ER (7), a nakonec zpracovány prostřednictvím Golgiho a začleněna do plazmatické membrány (9). Jakmile virion byl sestaven (8), váže se na virové transmembránové proteiny, nucleating o exocytic „váček“ (10), která je virion kompletní s virovou obálku.
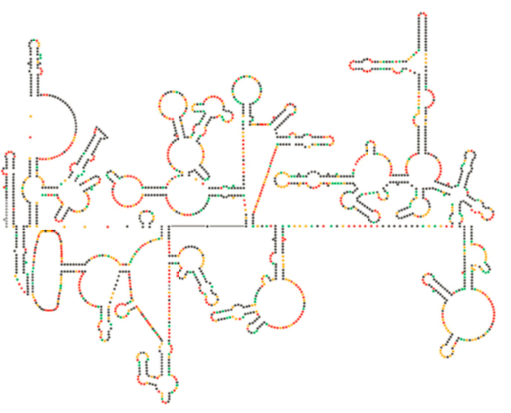
nedávné strukturální vyšetření genomu HIV naznačuje, že samotná struktura HIV RNA může hrát významnou roli při jejím šíření uvnitř hostitelských buněk. Číslo \(\PageIndex{8}\), z Watts et al, Nature 460:711-716, 2009, ukazuje předpokládanou sekundární strukturu genomu. Autoři naznačují, že struktura RNA může ve skutečnosti interagovat s ribozomálním prodloužením pro kontrolu skládání virových proteinů. Oni také předpokládat rozšíření tohoto argumentu, aby zahrnovala důležité genetické informace, zakódované nejen v nukleotidové sekvenci, ale sekundární struktury a terciární struktura RNA virus.
Při zvažování viry s ohledem na zbytek integrační kapitole, existují dva převažující nápady, jak udržet v mysli. Za prvé, virové přežití je založeno na číslech: potřebuje vytvořit obrovské množství svých složek, aby obsadil co nejširší síť pro nové hostitelské buňky. K tomu, virové promotory jsou obvykle mnohem silnější než promotory hostitelské buňky, současně řídit více virové genové exprese a zároveň zabránit hostitele genové exprese (vytvořením buněčné zdroje k virus výroby). Za druhé, protože rychle, generace časy, míra virové mutace a evoluce je mnohem rychlejší než normální eukaryotické genomy. Kromě toho, když virus používá vlastní polymerázu (např. reverzní transkriptázy nebo RNA replicase), mutace míra vzroste ještě více, protože neexistuje žádná kontrola chyb pomocí virové polymerázy.