16.2: wirusowe cykle życia
szlak Lizogeniczny
lepszym rozwiązaniem dla niektórych wirusów bakteryjnych jest tzw. szlak lizogeniczny. Bakteriofagi, które mają tę opcję,jak również szlak lityczny, są znane jako umiarkowany FAG. W tej ścieżce wirus przechodzi w stan uśpienia poprzez integrację z genomem gospodarza i pozostaje transkrypcyjnie w stanie uśpienia, aż do zmiany warunków środowiskowych i odzwierciedlają prawdopodobieństwo zarażenia większej liczby komórek gospodarza (rysunek \(\PageIndex{4}\)).
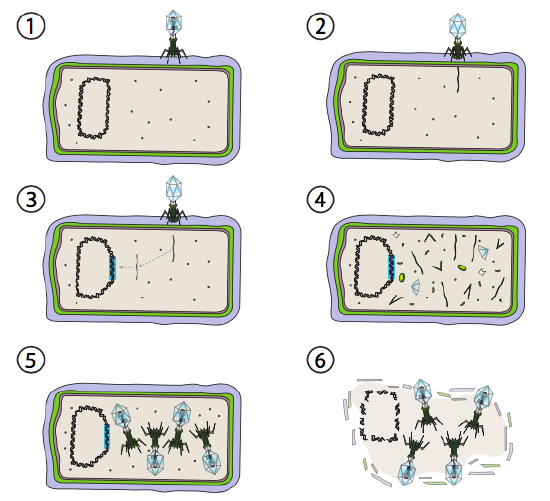
Lambda (λ) jest przykładem umiarkowanego bakteriofaga. Początkowe etapy infekcji i wstrzyknięcie genomu są takie same jak cykl lityczny, ale w warunkach sprzyjających lizogenie Genom wirusowy jest zintegrowany z genomem gospodarza w kroku 3. W λ integracji z E. coli, zachodzi to przez wzajemną rekombinację w sekwencji pary 15-zasadowej znanej jako miejsce att λ i jest ułatwiane przez produkt genu Int. Dopóki warunki środowiskowe nie sprzyjają rozmnażaniu bakterii (a tym samym ograniczonej liczbie możliwych komórek gospodarza), Genom wirusowy pozostaje w większości Ukryty i nieaktywny. Jedynym znaczącym wyjątkiem jest gen kodujący λ represor, który uniemożliwia następny krok i utrzymuje wirusa w stanie uśpienia.
następnym krokiem jest wycięcie DNA fagowego λ z chromosomu gospodarza, a następnie replikacja i transkrypcja DNA wirusa (rysunek \(\PageIndex{4}\), Krok 4). Następnie, podobnie jak wcześniej, końcowymi etapami są montaż i akumulacja wirionów, a ostatecznie rozpad struktury komórkowej i uwolnienie cząstek wirusa.
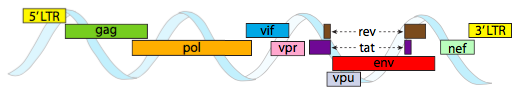
w celu zapakowania w ciasne ograniczenia przestrzeni zapewniane przez capsids, genomy wirusowe muszą być wysoce ekonomiczne. Na przykład, Genom HIV (rysunek \(\PageIndex{6}\)) ma kilka genów, które nakładają się na siebie.
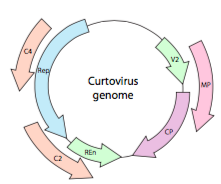
lub, w przypadku curtowirusów, wirusy roślinne ssDNA (np. wirus buraczany), Genom nie tylko ma geny nadpopingowe, ale jest nawet dwukierunkowy (rysunek \(\PageIndex{7}\)) kodujący produkty genowe w obu nici DNA po konwersji ssDNA do dsDNA.
biorąc pod uwagę potrzebę ekonomii, jakie geny znajdują się w wirusach? Jeden z najlepiej przebadanych genomów wirusowych, bakteriofag λ, zawiera geny kodujące pięć białek kontrolujących transkrypcję (które z nich ulegają ekspresji w zależności od tego, czy FAG znajduje się w trybie lizogennym czy litycznym), białko wiążące, które kontroluje degradację aktywatora transkrypcyjnego, 17 białek kapsydowych, excisionase, która kontroluje wycięcie i wstawienie genomu fagowego do genomu gospodarza, białko integrujące, które wstawia Genom fagowy do gospodarza i 3 geny uczestniczące w lizie komórki gospodarza.
Genom HIV przedstawiony powyżej jest znacznie mniejszy niż λ, przy około 9 kilobazach w porównaniu do 48 kb, ale ponownie tematem jest użycie białek komórkowych, jeśli to możliwe, i kodowanie genów wirusowych, jeśli to konieczne. Tak więc gag koduje białka kapsydowe, pol koduje odwrotną transkryptazę, integrazę i proteazę HIV (która rozszczepia produkty genów gag i pol w ich funkcjonalne białka), vif działa przeciwko wspólnemu enzymowi przeciwwirusowemu komórek gospodarza, vpr reguluje import jądrowy, Tat silnie zwiększa transkrypcję genów HIV, Rev eksportuje wirusowe RNA z jądra, vpu jest potrzebny do kiełkowania cząstek z gospodarza, env koduje glikoproteiny otoczki wirusowej, a nef Promuje przetrwanie zakażonych komórek. Regiony LTR są bardzo silnymi promotorami napędzającymi wysoką ekspresję tych genów.
chociaż nie jest określany jako lizogenia, niektóre wirusy zwierzęce mogą zachowywać się podobnie. Najbardziej znanym przykładem są wirusy klasy VI-powszechnie znane jako retrowirusy, z których jednym jest HIV. Droga retrowirusa przez eukariotyczną komórkę gospodarza jest przedstawiona poniżej (g. 5).
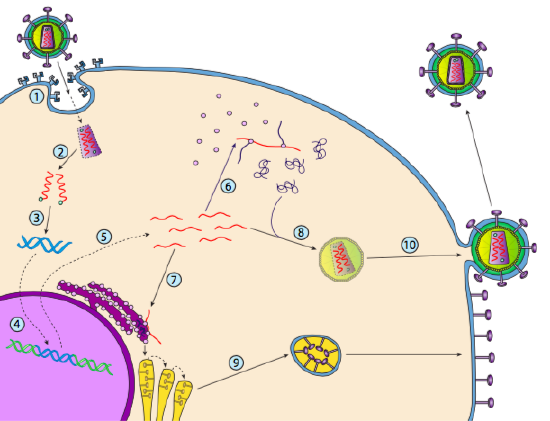
HIV ma otoczkę, która jest wysadzana białkami przezbłonowymi rozpoznawanymi przez komórkę gospodarza, wiążącymi wirusa z powierzchnią komórki i inicjującymi endocytozę mediowaną przez receptor (1). Po endocytozie otoczka błonowa wirionu i błona pęcherzykowa łączą się, uwalniając kapsyd i jego zawartość (2). Po dysocjacji kapsydu w cytoplazmie, dwie nici wirusowego RNA są uwalniane wraz ze specjalną polimerazą: odwrotną transkryptazą, która odczytuje szablon RNA i syntetyzuje DNA. Odwrotna transkryptaza wykorzystuje również to nowe DNA do syntezy komplementarnej nici DNA tak, że ostatecznie wytwarza dwuniciową wersję DNA genomu wirusa (3). Ten wirusowy dsDNA jest transportowany do jądra, gdzie integruje się z genomem gospodarza za pomocą innego białka wirusowego, integrazy
(4). Zintegrowane DNA wirusa nazywa się prowirusem. Prowirus może leżeć w stanie uśpienia, ale jeśli jest aktywowany, jest transkrybowany, a powstałe wirusowe RNA jest transportowane z jądra (5). Niektóre wirusowe RNA kodują enzymy, takie jak odwrotna transkryptaza i integraza lub białka kapsyd, z których wszystkie są wytwarzane w cytoplazmie (6), ale niektóre kodują glikoproteiny związane z błoną, które są przenoszone do ER (7) i ostatecznie przetwarzane przez Golgiego i włączane do błony plazmatycznej (9). Po złożeniu wirionu (8) wiąże się on z wirusowymi białkami transbłonowymi, zarodkując egzocytarny „pęcherzyk” (10), który jest wirionem wypełnionym otoczką wirusową.
ostatnie badania strukturalne genomu HIV sugerują, że sama struktura RNA HIV może odgrywać znaczącą rolę w jego propagacji wewnątrz komórek gospodarza. Rysunek \(\PageIndex{8}\), Z Watts et al, Nature 460: 711-716, 2009, pokazuje przewidywaną wtórną strukturę genomu. Autorzy sugerują, że struktura RNA faktycznie może oddziaływać z wydłużeniem rybosomalnym w celu kontrolowania fałdowania białek wirusowych. Postulują również rozszerzenie tego argumentu o ważną informację genetyczną zakodowaną nie tylko w sekwencji nukleotydowej, ale w strukturze drugorzędowej i trzeciorzędowej dowolnego wirusa RNA.
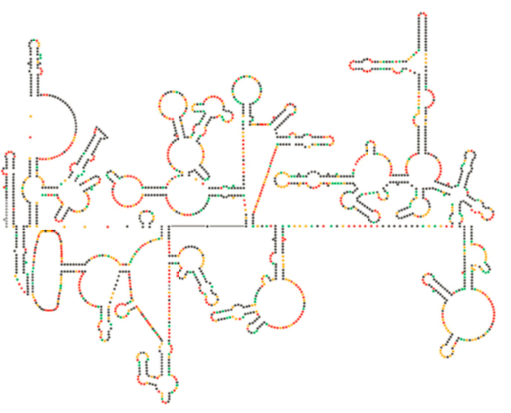
rozważając wirusy w odniesieniu do reszty tego rozdziału integracyjnego, należy pamiętać o dwóch nadrzędnych ideach. Po pierwsze, przetrwanie wirusa opiera się na liczbach: musi stworzyć ogromną liczbę swoich składników, aby jak najszersza Sieć dla nowych komórek gospodarza, jak to możliwe. Aby to zrobić, promotory wirusowe są zwykle znacznie silniejsze niż promotory komórek gospodarza, jednocześnie napędzając większą ekspresję genów wirusowych, zapobiegając ekspresji genów gospodarza (poprzez dedykowanie zasobów komórkowych do produkcji wirusów). Po drugie, ze względu na szybki czas generacji, tempo mutacji i ewolucji wirusa jest znacznie szybsze niż normalne genomy eukariotyczne. Ponadto, jeśli wirus używa własnej polimerazy (takiej jak odwrotna transkryptaza lub replikaza RNA), szybkość mutacji wzrasta jeszcze bardziej, ponieważ nie ma sprawdzania błędów przez polimerazy wirusowe.